题目内容
【题目】近期发现,H2S是继NO、CO之后第三个生命体系气体信号分子,它具有参与调节神经信号传递、舒张血管减轻高血压的功能。回答下列问题:
(1)下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。

通过计算,可知系统(Ⅰ)和系统(Ⅱ)制氢的热化学方程式分别为________________、______________,制得等量H2所需能量较少的是_____________(填“系统(Ⅰ)”或“系统(Ⅱ)”)。
(2)羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。H2S与CO2在高温下发生反应:H2S(g)+CO2(g)![]() COS(g) +H2O(g)。在610 K时,将1 mol CO2与1 mol H2S充入2 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
COS(g) +H2O(g)。在610 K时,将1 mol CO2与1 mol H2S充入2 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
①H2S的平衡转化率![]() =_______%,反应平衡常数K=________。
=_______%,反应平衡常数K=________。
②在620 K重复试验,平衡后水的物质的量分数为0.03,H2S的转化率![]() _____
_____![]() ,该反应的
,该反应的![]() H_____0。(填“>”、“<”或“=”)
H_____0。(填“>”、“<”或“=”)
③向反应器中再分别充入下列气体,能使H2S转化率增大的是________(填标号)
A.N2 B.H2S C.COS D.CO2
(3)25℃,在0.10 mol·L-1 H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-) 关系如下图(忽略溶液体积的变化、H2S的挥发)。

①硫化氢的电离方程式为__________________________。
②向硫化氢溶液中加入CuSO4溶液时,硫化氢的电离平衡向______(“左”或“右”)移动,c(S2-)_____________(填“增大”、“不变”或“减小”)。
③当调节溶液pH=13时,溶液中的c( H2S ) + c( HS-)=_____mol·L-1。
【答案】H2O(l)=H2(g)+ ![]() O2(g) ΔH=+286 kJ/mol H2S(g)=H2(g)+S(s) ΔH=+20 kJ/mol 系统(II) 4 1.7×10-3 > > D H2S
O2(g) ΔH=+286 kJ/mol H2S(g)=H2(g)+S(s) ΔH=+20 kJ/mol 系统(II) 4 1.7×10-3 > > D H2S![]() HS—+H+ 、HS—
HS—+H+ 、HS—![]() S2—+H+ 右 减小 0.043
S2—+H+ 右 减小 0.043
【解析】
(1)系统(Ⅰ)涉及水的分解,系统(Ⅱ)涉及硫化氢的分解,利用盖斯定律分别将系统(Ⅰ)和系统(Ⅱ)的热化学方程式相加,可得到水、硫化氢分解的热化学方程式;
(2)根据三段式结合反应平衡后水的物质的量分数为0.02,计算出各物质的平衡浓度,再结合平衡移动的影响因素分析解答;
(3)①硫化氢为弱电解质,分步电离;②向硫化氢溶液中加入CuSO4溶液,反应生成硫化铜沉淀,据此分析解答;③根据溶液pH与c(S2-)关系图pH=13时,c(S2-)=5.7×10-2mol/L,结合硫元素守恒分析解答。
(1)系统(Ⅰ)涉及水的分解,系统(Ⅱ)涉及硫化氢的分解,根据盖斯定律分别将系统(Ⅰ)和系统(Ⅱ)的热化学方程式相加,可得到水、硫化氢分解的热化学方程式,则系统(I)的热化学方程式为:H2O(l)=H2(g)+![]() O2(g)△H=(+327 kJ/mol)+(-151 kJ/mol)+(+110 kJ/mol)=+286kJ/mol;系统(II)的热化学方程式为:H2S (g)=H2(g)+S(s)△H=(-151 kJ/mol)+(+110 kJ/mol)+(+61 kJ/mol)=+20kJ/mol;根据系统I、系统II的热化学方程式可知:每反应产生1mol氢气,后者吸收的热量比前者少,所以制取等量的H2所需能量较少的是系统II,故答案为:H2O(l)=H2(g)+
O2(g)△H=(+327 kJ/mol)+(-151 kJ/mol)+(+110 kJ/mol)=+286kJ/mol;系统(II)的热化学方程式为:H2S (g)=H2(g)+S(s)△H=(-151 kJ/mol)+(+110 kJ/mol)+(+61 kJ/mol)=+20kJ/mol;根据系统I、系统II的热化学方程式可知:每反应产生1mol氢气,后者吸收的热量比前者少,所以制取等量的H2所需能量较少的是系统II,故答案为:H2O(l)=H2(g)+![]() O2(g)△H=+286kJ/mol;H2S (g)=H2(g)+S(s)△H=+20kJ/mol;系统(Ⅱ);
O2(g)△H=+286kJ/mol;H2S (g)=H2(g)+S(s)△H=+20kJ/mol;系统(Ⅱ);
(2)设反应的硫化氢为xmol ,
对于反应H2S(g)+CO2(g)COS(g)+H2O(g)
起始(mol) 1 1 0 0
转化(mol) x x xx
平衡(mol) 1-x 1-x xx
反应平衡后水的物质的量分数为0.02,则![]() =0.02,x=0.04。
=0.02,x=0.04。
①H2S的平衡转化率a1=![]() ×100%=4%,体积为2.0L,则平衡时各物质的浓度为c(H2S)=
×100%=4%,体积为2.0L,则平衡时各物质的浓度为c(H2S)=![]() mol/L=0.48mol/L,c(CO2)=
mol/L=0.48mol/L,c(CO2)=![]() mol/L=0.48mol/L,c(COS)=c(H2O)=
mol/L=0.48mol/L,c(COS)=c(H2O)=![]() mol/L=0.02mol/L,则K=
mol/L=0.02mol/L,则K=![]() ≈1.7×10-3,故答案为:4;1.7×10-3;
≈1.7×10-3,故答案为:4;1.7×10-3;
②根据题目提供的数据可知温度由610K升高到620K时,化学反应达到平衡,水的物质的量分数由0.02变为0.03,说明平衡正向移动了,所以H2S的转化率增大,a2>a1;根据题意可知:升高温度,化学平衡向正反应方向移动,根据平衡移动原理,升高温度,化学平衡向吸热反应方向移动,所以该反应的正反应为吸热反应,故△H>0,故答案为:>;>;
③A.N2是与反应体系无关的气体,充入N2,不能使化学平衡发生移动,所以对H2S转化率无影响,故A错误;B.增大H2S的浓度,平衡正向移动,但加入量远远大于平衡移动转化的消耗量,所以H2S转化率降低,故B错误;C.COS是生成物,增大生成物的浓度,平衡逆向移动,H2S转化率降低,故C错误;D.增大CO2的浓度,平衡正向移动,H2S转化率增大,故D正确;故答案为:D;
(3)①硫化氢为弱电解质,分步电离,电离方程式为H2S![]() HS—+H+ ,HS—
HS—+H+ ,HS—![]() S2—+H+,故答案为:H2S
S2—+H+,故答案为:H2S![]() HS—+H+ ,HS—
HS—+H+ ,HS—![]() S2—+H+;
S2—+H+;
②向硫化氢溶液中加入CuSO4溶液,反应生成硫化铜沉淀,硫离子浓度减小,促进硫化氢的电离平衡向右移动,故答案为:右;减小;
③根据溶液pH与c(S2-)关系图pH=13时,c(S2-)=5.7×10-2mol/L,在0.10molL-1H2S溶液中,根据硫守恒c(H2S)+c(HS-)+c(S2-)=0.10molL-1,所以c(H2S)+c(HS-)=0.1-5.7×10-2=0.043mol/L,故答案为:0.043。

【题目】Bodensteins研究了下列反应:2HI(g)![]() H2(g)+I2(g) H=+11 kJ·mol-1。在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
H2(g)+I2(g) H=+11 kJ·mol-1。在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
t/min | 0 | 20 | 40 | 60 | 80 | 120 |
x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用如图表示。当改变条件,再次达到平衡时,下列有关叙述不正确的是
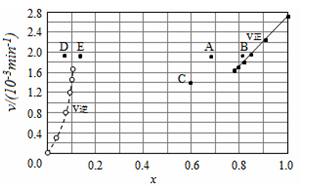
A.若升高温度到某一温度,再次达到平衡时,相应点可能分别是A、E
B.若再次充入a mol HI,则达到平衡时,相应点的横坐标值不变,纵坐标值增大
C.若改变的条件是增大压强,再次达到平衡时,相应点与改变条件前相同
D.若改变的条件是使用催化剂,再次达到平衡时,相应点与改变条件前不同