题目内容
1.化学实验需要0.1mol/LNaOH溶液230mL,甲同学负责配制,图1是他转移溶液的示意图,请你帮助解决下列问题: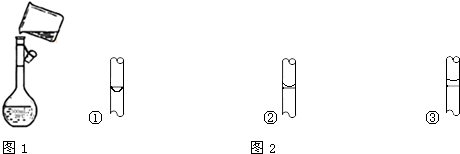
(1)图中的一个重要操作错误是转移液体时未用玻璃棒引流.
(2)甲同学应选择250mL的容量瓶,用托盘天平称取NaOH的质量为1.0g.
(3)请填写下列各步骤中的空白,并排列“配制一定物质的量浓度溶液”的正确的操作顺序(用字母表示,每个字母只能用一次)BCAFED.
A.用30mL水洗涤烧杯2-3次,洗涤液均注入容量瓶,在操作过程中不能损失点滴液体,否则会使溶液的浓度偏低(填“偏高”或“偏低”).
B.准确称取计算好的NaOH固体于烧杯中,再加入少量水(约30mL),用玻璃棒(填仪器名称)慢慢搅动,使其充分溶解.
C.将溶解的NaOH溶液冷却到室温后,转移入容量瓶中.若趁热转移会使溶液的浓度偏高(填“偏高”或“偏低”).
D.将容量瓶盖紧,振荡,摇匀,并转移入试剂瓶中,贴上标签.
E.改用胶头滴管加水定容,图2中液面位置正确的是②(填序号).若加水超过刻度线,处理方法是应该重新配制.
F.继续往容量瓶内小心加水,直到液面接近刻度线1~2cm处.
分析 (1)根据配制一定物质的量浓度的溶液的方法和操作来寻找装置中的错误;
(2)根据配制溶液的实验操作过程选择所用仪器;
(3)根据操作步骤有计算、称量、溶解、移液、洗涤移液、定容、摇匀等操作步骤确定顺序;根据公式c=$\frac{n}{V}$来确定实验误差的原因和结果.
解答 解:(1)配制一定物质的量浓度的溶液是必须用玻璃棒引流,防止液体外溅;
故答案为:没有用玻璃棒引流;
(2)没有230mL规格容量瓶,所以选用250mL容量瓶,需氢氧化钠的质量为m=0.25L×0.1mol•L-1×40g/mol=1.0g;
故答案为:250;0.1;
(3)配制溶液250mL,配制步骤有称量、溶解、移液、洗涤、移液、定容、摇匀等操作,用托盘天平称量1.0gNaOH,在烧杯中溶解,并用玻璃棒搅拌,冷却后转移到500mL容量瓶中,并用玻璃棒引流,洗涤,并将洗涤液移入容量瓶,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,使溶液凹液面的最低点与刻度线相切,最后定容颠倒摇匀,所以操作顺序为BCAFED;
用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,在操作过程中不损失点滴液体,否则溶质的物质的量偏小,会使溶液的浓度偏低;溶解后未冷却至室温就转移到容量瓶,会使定容后溶液体积低于刻度线,浓度偏高;读数时,凹液面的最低点与刻度线相切;若加水超过刻度线,溶液的体积偏大,会造成溶液浓度偏小,应重新配制;
故答案为:BCAFED;低;玻璃棒;偏高;②;重新配制;1-2cm.
点评 本题考查了配制一定物质的量浓度的溶液的方法及误差分析,易错题是②,注意配制230mL溶液需要选用250mL容量瓶,本题难度不大.

练习册系列答案
相关题目
11. 25℃时,用Na2S沉淀Cu2+、Zn2+两种金属离子(M2+),所需S2-最低浓度的对数值lgc(S2-)与lgc(M2+)的关系如图所示,下列说法不正确的是( )
25℃时,用Na2S沉淀Cu2+、Zn2+两种金属离子(M2+),所需S2-最低浓度的对数值lgc(S2-)与lgc(M2+)的关系如图所示,下列说法不正确的是( )
 25℃时,用Na2S沉淀Cu2+、Zn2+两种金属离子(M2+),所需S2-最低浓度的对数值lgc(S2-)与lgc(M2+)的关系如图所示,下列说法不正确的是( )
25℃时,用Na2S沉淀Cu2+、Zn2+两种金属离子(M2+),所需S2-最低浓度的对数值lgc(S2-)与lgc(M2+)的关系如图所示,下列说法不正确的是( )| A. | Na2S溶液中:c(S2-)+c(HS-)+c(H2S)═2c(Na+) | |
| B. | 25℃时K甲(CuS)约为1×10-35 | |
| C. | 向100mLZn2+、Cu2+浓度均为10-5mol•L-1的混合溶液中逐滴加入10-4mol•L-1的Na2S溶液,Cu2+先沉淀 | |
| D. | 向Cu2+浓度为10-5mol•L-1的工业废水中加入ZnS粉末,会有CuS沉淀析出 |
12.按图示装置,实验能够成功的是( )


| A. | 装置用于检验溴丙烷消去产物 | B. | 装置用于测定乙醇的结构式 | ||
| C. | 装置用于提取I2的CCl4溶液中的I2 | D. | 装置用于除去甲烷中的乙烯 |
9.乙醇汽油是在乙醇中加适量的汽油混合而成的一种燃料,是目前推广使用的一种燃料.下列叙述错误是( )
| A. | 汽车使用乙醇汽油能减少有害气体的排放 | |
| B. | 乙醇汽油是一种新型化合物 | |
| C. | 通过石油的催化裂化可以炼制汽油 | |
| D. | 用玉米高梁发酵可以制得乙醇 |
16.下列各有机物完全燃烧时,生成二氧化碳与水的质量之比44:9的是( )
| A. | 乙烷 | B. | 乙烯 | C. | 乙炔(C2H2) | D. | 苯 |
6.2011年6月26日是第十七个“国际禁毒日”,其主题是“青少年与合成毒品”.你认为下列各组物质中,都属于毒品的是( )
| A. | 冰毒、阿莫西林 | B. | 海洛因、雷尼替丁 | ||
| C. | 黄曲霉素、诺氟沙星 | D. | 海洛因、摇头丸 |