题目内容
8.一定温度下,向恒容密闭容器中通入气体C,发生反应mA(g)+nB(g)?pC(g).能肯定该反应达到平衡状态的标志是( )| A. | 混合气体的密度不随时间改变 | B. | 容器内气体的压强不随时间改变 | ||
| C. | C的分解率不随时间改变 | D. | v(A):v(B):v(C)=m:n:p |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:A、混合气体的密度始终不随时间改变而改变,故A错误;
B、如果m+n=p,容器内气体的压强始终不随时间改变而改变,故B错误;
C、C的分解率不随时间改变,说明C的物质的量不变,达化学平衡状态,故C正确;
D、从反应开始就符合v(A):v(B):v(C)=m:n:p,所以不一定是平衡状态,故D错误;
故选C.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.

练习册系列答案
 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案 出彩同步大试卷系列答案
出彩同步大试卷系列答案
相关题目
18.烟雾传感器中的放射源是241Am.已知Am的原子序数为95.下列关于241Am的说法正确的是( )
| A. | 241Am的中子数与电子数之差为146 | B. | 241Am与243Am的核外电子数相等 | ||
| C. | 241Am与243Am是同种核素 | D. | 241Am与243Am的化学性质不同 |
16.下面是用电子式表示某些物质的形成过程,其中正确的是( )
| A. | H•+ →H+[ →H+[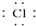 ]- ]- | B. | K•+ →K →K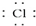 | C. | 2H•+ →H →H H H | D. | 2Na•+ →Na →Na Na Na |
20.1791年,法国医生路布兰首先获得制碱专利,以食盐、浓硫酸、石灰石、煤为原料制碱,该方法分三步:
①用NaCl与H2SO4反应制Na2SO4:2NaCl+H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Na2SO4+2HCl↑
②用焦炭还原Na2SO4制Na2S:Na2SO4+4C$\frac{\underline{\;煅烧\;}}{\;}$Na2S+4CO↑
③用硫化钠与石灰石反应制Na2CO3:Na2S+CaCO3$\frac{\underline{\;煅烧\;}}{\;}$Na2CO3+CaS
下列说法正确的是( )
①用NaCl与H2SO4反应制Na2SO4:2NaCl+H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Na2SO4+2HCl↑
②用焦炭还原Na2SO4制Na2S:Na2SO4+4C$\frac{\underline{\;煅烧\;}}{\;}$Na2S+4CO↑
③用硫化钠与石灰石反应制Na2CO3:Na2S+CaCO3$\frac{\underline{\;煅烧\;}}{\;}$Na2CO3+CaS
下列说法正确的是( )
| A. | 第②步中氧化剂与还原剂的物质的量之比为1:4 | |
| B. | 反应①体现了硫酸的强酸性 | |
| C. | 该方法对环境污染较小 | |
| D. | 该方法对生产设备基本没有腐蚀 |
17.白藜芦醇的结构简式为: ,它广泛存在于食物(例如桑葚、花生尤其是葡萄)中,具有抗癌性.能够跟1mol该化合物起反应昀Br2或H2的最大用量分别是( )
,它广泛存在于食物(例如桑葚、花生尤其是葡萄)中,具有抗癌性.能够跟1mol该化合物起反应昀Br2或H2的最大用量分别是( )
 ,它广泛存在于食物(例如桑葚、花生尤其是葡萄)中,具有抗癌性.能够跟1mol该化合物起反应昀Br2或H2的最大用量分别是( )
,它广泛存在于食物(例如桑葚、花生尤其是葡萄)中,具有抗癌性.能够跟1mol该化合物起反应昀Br2或H2的最大用量分别是( )| A. | 1mol,1mol | B. | 3.5mol,7mol | C. | 3.5mol,6mol | D. | 6mol,7mol |
5.下列反应中,属于加成反应的是( )
| A. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl | |
| B. | CH2=CH2+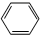 $\stackrel{一定条件}{→}$ $\stackrel{一定条件}{→}$ | |
| C. | CH3COOCH2CH3+NaOH$\stackrel{△}{→}$CH3COONa+CH3CH2OH | |
| D. |  +Br2$\stackrel{FeBr_{3}}{→}$ +Br2$\stackrel{FeBr_{3}}{→}$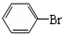 +HBr +HBr |

 ,乙烯燃烧时的现象是火焰明亮,伴有黑烟,放热;
,乙烯燃烧时的现象是火焰明亮,伴有黑烟,放热;