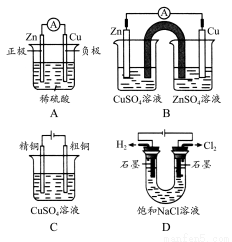
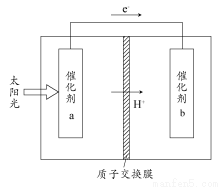
题目内容
A、B、C、D、E是位于短周期的主族元素,其中A、B为金属元素。已知:①热稳定性:HmD>HmC;②Cm-、E(m-1)-具有相同的电子层结构;③B与E在同一周期,在该周期中,E的原子半径最小,B的离子半径最小;④A、B所形成的单核离子具有相同的电子层结构,B的最高价氧化物对应的水化物与A、E的最高价氧化物对应的水化物都能反应。依据上述信息用相应的化学用语回答下列问题:
(1)HmD的电子式:________。
(2)Cm-和E(m-1)-的还原性强弱为________>________,能证明其还原性强弱的离子方程式为________________________________________。
(3)写出B的最高价氧化物对应的水化物和A的最高价氧化物对应的水化物反应的离子方程式_____________________________________。
(4)常温下,将等物质的量浓度的HmC溶液和A的最高价氧化物对应的水化物溶液等体积混合,所得溶液显碱性,溶液中离子浓度由大到小的顺序为________。
(5)在B、C、E单质中,符合下列转化关系的是________。
单质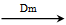 化合物一
化合物一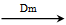 化合物二
化合物二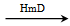 最高价氧化物
最高价氧化物
对应的水化物
(1)H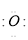 H
H
(2)S2- Cl- Cl2+S2-=2Cl-+S↓
(3)Al(OH)3+OH-=AlO2—+2H2O
(4)c(Na+)>c(HS-)>c(OH-)>c(H+)>c(S2-)
(5)S
【解析】由于E能形成阴离子,则E为非金属元素。根据B的最高价氧化物对应的水化物与A、E的最高价氧化物对应的水化物都能反应,则B的最高价氧化物对应的水化物具有两性,故B为Al。根据A、B所形成的单核离子具有相同的电子层结构,则A、B在同一周期,故A为Na。根据B、E在同一周期且该周期中E原子半径最小,则E为Cl,根据Cm-与E(m-1)-具有相同的电子层结构,则m=2,故C为S。根据热稳定性H2D>H2S,则D为O。(1)H2O的电子式为H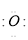 H。(2)非金属性Cl>S,还原性S2->Cl-,可以根据单质间的置换反应证明还原性强弱。(3)Al(OH)3和NaOH溶液反应的离子方程式为:Al(OH)3+OH-=AlO2—+2H2O。(4)等物质的量的H2S与NaOH溶液反应得到NaHS溶液,由于溶液显碱性,说明HS-的水解程度大于电离程度,故离子浓度大小为c(Na+)>c(HS-)>c(OH-)>c(H+)>c(S2-)。(5)根据图示中转化关系,该单质能够连续氧化,故为S。
H。(2)非金属性Cl>S,还原性S2->Cl-,可以根据单质间的置换反应证明还原性强弱。(3)Al(OH)3和NaOH溶液反应的离子方程式为:Al(OH)3+OH-=AlO2—+2H2O。(4)等物质的量的H2S与NaOH溶液反应得到NaHS溶液,由于溶液显碱性,说明HS-的水解程度大于电离程度,故离子浓度大小为c(Na+)>c(HS-)>c(OH-)>c(H+)>c(S2-)。(5)根据图示中转化关系,该单质能够连续氧化,故为S。

 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案