题目内容
【题目】(1)二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全剂而且与Cl2相比不会产生对人体有潜在危害的有机氯代物。制备ClO2有下列两种方法:
方法一:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
方法二:2NaClO3+H2O2+H2SO4=2ClO2↑+O2↑+Na2SO4+2H2O
方法一
① 氧化剂 、氧化产物 、
②氧化剂与还原剂物质的量比 。
③用双线桥法标明电子转移的方向和数目
方法二
④被氧化的物质是 ________
⑤若反应中有0.1 mol电子转移,则产生的ClO2气体在标准状况下的体积为________L;
(2)某无色透明溶液与金属铝反应放出H2,试判断下列离子:Mg2+、Cu2+、Ba2+、H+、Ag+、SO42-、HCO3-、OH-、NO3-哪些能大量共存。
⑥当生成Al3+ 时,可能存在 _。
⑦当生成AlO2- 时,可能存在 _。
【答案】
(1)① NaClO3;Cl2;②1 :1;
③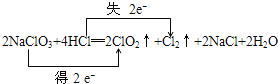 ;④ H2O2;⑤ 2.24;
;④ H2O2;⑤ 2.24;
(2) ⑥Mg2+;⑦NO3-。
【解析】
试题分析:(1)①化合价升高元素Cl所在的反应物HCl是还原剂,对应产物Cl2是氧化产物;化合价降低Cl元素所在的反应物NaClO3是氧化剂,所在的产物ClO2是还原产物;故答案为:NaClO3; Cl2;
②化合价升高元素所在的反应物HCl是还原剂,4mol盐酸参加反应,一半做还原剂,化合价降低Cl元素所在的反应物NaClO3是氧化剂,氧化剂与还原剂物质的量比是1:1,故答案为:1:1;
③反应2NaClO3+4HCl═2ClO2↑+Cl2↑+2NaCl+2H2O中,化合价升高元素Cl所在的反应物HCl,是还原剂,合价降低Cl元素所在的反应物NaClO3是氧化剂,化合价降低值=化合价升高值=转移电子数=2,电子转移如下: ,故答案为:
,故答案为: ;
;
④化合价升高的元素是H2O2中的O元素在反应中被氧化,故答案为:H2O2;
⑤反应2NaClO3+H2O2+H2SO4═2ClO2↑+O2↑+Na2SO4+2H2O中,有2mol电子转移,则产生的ClO2气体2mol,若反应中有0.1mol电子转移,则产生的ClO2气体0.1mol,在标准状况下的体积为0.1mol×22.4L/mol=2.24L,故答案为:2.24。
(2)溶液无色,则一定不存在Cu2+离子;与金属铝反应放出H2,该溶液为酸性或强碱性溶液。
⑥当生成Al3+时,说明溶液呈酸性,一定存在:H+,一定不存在:HCO3-、OH-,因在含HNO3的溶液中放入Al不生成H2,则一定不存在NO3-离子,酸性溶液中不存在HCO3-、OH-离子,根据溶液电荷守恒,则溶液中一定存在阴离子,即SO42-离子一定存在,而Ba2+、Ag+与SO42-离子生成难溶或微溶于水的沉淀,则一定不存在Ba2+、Ag+离子,则可能大量存在Mg2+,故答案为:Mg2+;
⑦当生成AlO2-时,说明溶液呈碱性,溶液中存在大量的OH-离子,与OH-离子反应的Mg2+、Cu2+、H+、Ag+、HCO3-离子不能大量存在,根据溶液电荷守恒,则溶液中一定存在阳离子,即Ba2+离子一定存在,而Ba2+与SO42-离子生成难溶于水的沉淀,则一定不存在SO42-离子,则一定大量存在OH-、Ba2+,可能存在NO3-,故答案为:NO3-。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案