题目内容
【题目】下列说法正确的是( )
A.常温下,向0.1mol·L-1的醋酸溶液中加水稀释,溶液中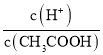 增大
增大
B.反应N2(g)+3H2(g) ![]() 2NH3(g) △H<0达平衡后,降低温度,正反应速率增大、逆反应速率减小,平衡向正反应方向移动
2NH3(g) △H<0达平衡后,降低温度,正反应速率增大、逆反应速率减小,平衡向正反应方向移动
C.铜锌原电池中,盐桥中的K+和NO3-分别移向正极和负极
D.电解精炼铜时,阳极泥中含有Zn、Fe、Ag、Au等金属
【答案】AC
【解析】
A.常温下,向0.1mol/L的醋酸溶液中加水稀释,c(H+)、c(CH3COOH)均减小,因为稀释促进电离,所以溶液中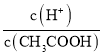 增大,故A项正确;
增大,故A项正确;
B.反应![]() 达平衡后,降低温度,正反应速率减小、逆反应速率也减小,平衡向放热反应方向移动,即向正向移动,所以B项错误;
达平衡后,降低温度,正反应速率减小、逆反应速率也减小,平衡向放热反应方向移动,即向正向移动,所以B项错误;
C.铜锌原电池中阳离子移向正极,阴离子移向负极,所以盐桥中的K+和NO3-分别移向正极和负极,故C项正确;
D.电解精炼铜时,粗铜作阳极,精铜作阴极,Zn、Fe比铜活泼,所以失电子变成离子,阳极泥中含有的是Ag、Au等金属,故D项错误;
答案选:AC。

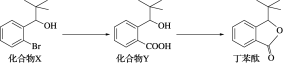
【题目】(1)某课外小组设计的实验室制取乙酸乙酯的装置如下图所示。请回答:
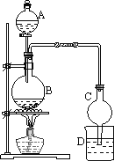
①若用 18O 标记乙醇中的氧原子,则 CH3CH218OH 与乙酸反应的化学方程式是_____________。
②球形干燥管C 的作用是______________。
③D 中选用饱和碳酸钠溶液的原因是_____________。
④反应结束后D 中的现象是_____________。
⑤下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有_____________(填序号)。
A.单位时间里,生成 1mol 乙酸乙酯,同时生成 1mol 水
B.单位时间里,消耗 1mol 乙醇,同时消耗 1mol 乙酸
C.正反应的速率与逆反应的速率相等
D.混合物中各物质的浓度不再变化
(2)N-苯基苯甲酰胺( 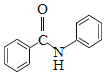 )广泛应用于药物,可由苯甲酸(
)广泛应用于药物,可由苯甲酸(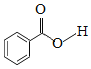 )与苯胺(
)与苯胺(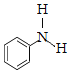 )反应制得,由于原料活性低,可采用硅胶催化、微波加热的方式,微波直接作用于分子,促进活性部位断裂,可降低反应温度。取得粗产品后经过洗涤—重结晶等,最终得到精制的成品。
)反应制得,由于原料活性低,可采用硅胶催化、微波加热的方式,微波直接作用于分子,促进活性部位断裂,可降低反应温度。取得粗产品后经过洗涤—重结晶等,最终得到精制的成品。
已知:
| 水 | 乙醇 | 乙醚 |
苯甲酸 | 微溶 | 易溶 | 易溶 |
苯胺 | 易溶 | 易溶 | 易溶 |
N-苯基苯甲酰胺 | 不溶 | 易溶于热乙醇,冷却后易 于结晶析出 | 微溶 |
下列说法不正确的是_____________(填字母编号)。
A.反应时断键位置为C—O 键和 N—H 键
B.洗涤粗产品用水比用乙醚效果更好
C.产物可选用乙醇作为溶剂进行重结晶提纯
D.硅胶吸水,能使反应进行更完全