题目内容
3.下列化合物中含有手性碳原子的是( )| A. | 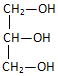 | B. |  | C. | CCl2F2 | D. | H2N-CH2-COOH |
分析 手性碳原子是指连有四个不同基团的碳原子,手性碳原子判断注意:①手性碳原子一定是饱和碳原子;②手性碳原子所连接的四个基团要是不同的,据此进行解答.
解答 解:A. 分子中,所有的碳原子所连接的四个基团都有一样的,不存在手性碳原子,故A错误;
分子中,所有的碳原子所连接的四个基团都有一样的,不存在手性碳原子,故A错误;
B. 分子中,有一个碳原子所连的四个取代基分别是羟基、甲基、氢原子和羧基,该碳原子具有手性,故B正确;
分子中,有一个碳原子所连的四个取代基分别是羟基、甲基、氢原子和羧基,该碳原子具有手性,故B正确;
C.CCl2F2分子中,碳原子所连接的4个基团有2个是一样的Cl,另2个是一样的F,没有手性碳原子,故C错误;
D.H2N-CH2-COOH中,-CH2-中含有2个H,羧基的碳原子中只含有3个取代基,该有机物中不存在手性碳原子,故D错误;
故选B.
点评 本题考查手性碳原子的判断,题目难度不大,明确存在手性碳原子的条件为解答关键,注意掌握手性碳原子的概念及判断方法,试题培养了学生的灵活应用能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
16.某有机化合物的结构简式为: ,它可以发生反应的类型有( )
,它可以发生反应的类型有( )
①加成 ②消去 ③水解 ④酯化 ⑤氧化 ⑥加聚,其中组合完全且正确的是.
 ,它可以发生反应的类型有( )
,它可以发生反应的类型有( )①加成 ②消去 ③水解 ④酯化 ⑤氧化 ⑥加聚,其中组合完全且正确的是.
| A. | ①②③④ | B. | ①②⑤⑥ | C. | ①②④⑤ | D. | ①②③④⑤ |
11.下列有关同分异构体数目的叙述错误的是( )
| A. | 甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物共有5种 | |
| B. | 菲的结构简式如图 ,它与硝酸反应,可生成5种一硝基取代物 ,它与硝酸反应,可生成5种一硝基取代物 | |
| C. | 与 互为同分异构体的芳香族化合物有6种 互为同分异构体的芳香族化合物有6种 | |
| D. | 某饱和链烃,分子中含有5个碳原子的,其一氯取代物共有8种 |
18.如图表示室温时水溶液中M2+的存在形式与pH的关系,其中纵坐标为M2+或M(OH)42-物质的量浓度的对数.下列说法不正确的是( )
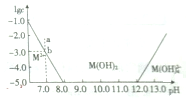

| A. | M(OH)2属于两性氢氧化物 | |
| B. | 沉淀分离M2+需控制pH在8~12之间 | |
| C. | 升高温度,可以实现从b点移动到a点 | |
| D. | 室温时,M(OH)2(s)的溶度积常数为1×10-17 |
15.部分弱酸的电离常数如表
下列有关说法正确的是( )
| 弱酸 | HCOOH | HCN | H2S |
| 电离平衡常数(25℃) | Ka=1.8×10-4 | Ka=4.9×10-10 | Ka1=1.3×10-7 Ka2=7.1×10-15 |
| A. | NaHS溶液中加入适量KOH后:c(Na+)═c(H2S)+c(HS-)+2C(S2-) | |
| B. | HCOO-、CN-、HS-在溶液中不可以大量共存 | |
| C. | 等体积、等浓度的HCOONa和NaCN两溶液中所含离子数目前者大于后者 | |
| D. | 恰好中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者大于后者 |
11.中和热测定实验中,用50mL 0.50mol/L盐酸和50mL 0.55mol/LNaOH进行实验,下列说法不正确的是( )


| A. | 改用60 mL 0.50 mol/L盐酸跟50 mL 0.55 mol/L NaOH溶液进行反应,求出的中和热数值和原来相同 | |
| B. | 用50 mL 0.50 mol/L盐酸和50 mL 0.55 mol/L NaOH进行实验比用 50 mL 0.50 mol/L盐酸和50 mL 0.50 mol/L NaOH测得的数值准确 | |
| C. | 酸碱混合时,量筒中NaOH溶液应缓缓倒入小烧杯中,不断用玻璃棒搅拌 | |
| D. | 装置中的大小烧杯之间填满碎泡沫塑料的作用是保温隔热、减少热量损失 |

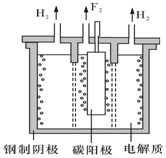 氟是自然界中广泛分布的元素之一.由于氟的特殊化学性质,它和其他卤素在单质及化合物的制备与性质上存在较明显的差异.
氟是自然界中广泛分布的元素之一.由于氟的特殊化学性质,它和其他卤素在单质及化合物的制备与性质上存在较明显的差异.