题目内容
11.分子式为C6H12O2的有机物A,能发生银镜反应,且在酸性条件下水解生成有机物B和C,其中C能被催化氧化成醛,则A可能的结构共有( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 8种 |
分析 有机物A能够发生银镜反应,说明其分子中含有醛基,且在酸性条件下水解生成有机物B和C,其中C能被催化氧化成醛,则A为甲酸酯、B为甲酸、C为戊醇,且醛基位于末端C原子,据此进行解答.
解答 解:分子式为C6H12O2的有机物A,能发生银镜反应,说明其分子中含有醛基;且A在酸性条件下水解生成有机物B和C,其中C能被催化氧化成醛,则A为甲酸、C为戊醇,且戊醇中羟基位于末端C原子,
满足条件的有机物有:HCOOCH2CH2CH2CH2CH3、HOOCH2CH(CH3)CH2CH3、HCOOCH2CH2CH(CH3)2、HOOCH2C(CH3)3,总共有4种,
故选B.
点评 本题考查同分异构体的书写,题目难度中等,明确常见有机物组成、结构与性质为解答关键,注意掌握同分异构体的书写原则,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 导学全程练创优训练系列答案
导学全程练创优训练系列答案
相关题目
3.下列化合物中含有手性碳原子的是( )
| A. | 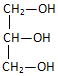 | B. |  | C. | CCl2F2 | D. | H2N-CH2-COOH |
3.硫酸亚铁铵[(NH4)2Fe(SO4)2]是一种重要的化工原料,用途十分广泛.它可以作净水剂,在无机化学工业中,它是制取其它铁化合物的原料.
【査阅资料】隔绝空气加热至500℃时硫酸亚铁铵能完全分解,分解产物中含有铁氧化物、硫氧化物、氨气和水蒸气等.
【实验探究】某化学小组选用图1所示部分装置进行实验(部分夹持装置略)
(1)验证分解产物中含有氨气和水蒸气,并探究残留固体成分.
①所选用装置的正确连接顺序为ACBD(填装置的字母序号).
②A中固体完全分解后变为红棕色粉末,设计实验证明A中残留固体仅为Fe2O3,而不含 FeO 或 Fe3O4:取少量A中残留固体加入适量稀硫酸使其完全溶解,向溶液中滴加少量酸性高锰酸钾溶液,若高锰酸钾溶液不褪色,则残留固体是Fe2O3而不含FeO和Fe3O4.
(2)探究分解产物中的硫氧化物,连接装置A-E-F-B进行实验.
①实验过程中观察到:E中没有明显现象,F中溶液褪色,据此得出的结论是分解产物中有SO2,没有SO3.
②实验证明(NH4)2Fe(SO4)2受热分解除上述产物外,还有N2生成,写出A中反应的化学方程式2(NH4)2Fe(SO4)2$\frac{\underline{\;500°C\;}}{\;}$Fe2O3+4SO2↑+2NH3↑+N2↑+5H2O↑.
(3)已知BaSO3、BaSO4均难溶于水,化学小组利用上述实验分离出的SO2气体,进行与可溶性钡盐溶液反应的探究实验(图2).
①步骤Ⅱ的现象说明实验中产生的白色沉淀是BaSO4(填化学式).
②关于G中有白色沉淀产生的原因,你认为可能是由于装置中的氧气参加了反应.
③写出H中发生反应的离子方程式3SO2+3Ba2++2NO3-+2H2O=3BaSO4↓+2NO↑+4H+.
【査阅资料】隔绝空气加热至500℃时硫酸亚铁铵能完全分解,分解产物中含有铁氧化物、硫氧化物、氨气和水蒸气等.
【实验探究】某化学小组选用图1所示部分装置进行实验(部分夹持装置略)

(1)验证分解产物中含有氨气和水蒸气,并探究残留固体成分.
①所选用装置的正确连接顺序为ACBD(填装置的字母序号).
②A中固体完全分解后变为红棕色粉末,设计实验证明A中残留固体仅为Fe2O3,而不含 FeO 或 Fe3O4:取少量A中残留固体加入适量稀硫酸使其完全溶解,向溶液中滴加少量酸性高锰酸钾溶液,若高锰酸钾溶液不褪色,则残留固体是Fe2O3而不含FeO和Fe3O4.
(2)探究分解产物中的硫氧化物,连接装置A-E-F-B进行实验.
①实验过程中观察到:E中没有明显现象,F中溶液褪色,据此得出的结论是分解产物中有SO2,没有SO3.
②实验证明(NH4)2Fe(SO4)2受热分解除上述产物外,还有N2生成,写出A中反应的化学方程式2(NH4)2Fe(SO4)2$\frac{\underline{\;500°C\;}}{\;}$Fe2O3+4SO2↑+2NH3↑+N2↑+5H2O↑.
(3)已知BaSO3、BaSO4均难溶于水,化学小组利用上述实验分离出的SO2气体,进行与可溶性钡盐溶液反应的探究实验(图2).
| 序号 | 步骤 | 现象 |
| I | 向图2装置内充SO2气体 | G中:有气泡冒出,产生白色沉淀;H中:有气泡冒出,产生白色沉淀;液面上方先略显红棕色,后逐渐消失 |
| Ⅱ | 从G、H中过滤出白色沉淀,分别加入稀盐酸中 | G、H中的白色沉淀均不溶解 |
②关于G中有白色沉淀产生的原因,你认为可能是由于装置中的氧气参加了反应.
③写出H中发生反应的离子方程式3SO2+3Ba2++2NO3-+2H2O=3BaSO4↓+2NO↑+4H+.
16.已知C4H10的同分异构体有2种,则C4H9OH属于醇类的同分异构体共有( )
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
3.草酸(HOOCCOOH)与分子式为C4H10O的醇在一定条件下进行酯化反应,可得到二元酯最多有(不考虑立体异构)( )
| A. | 6种 | B. | 8种 | C. | 10种 | D. | 14种 |
20.分子式为C9H10O2,并能与饱和NaHCO3溶液反应放出气体的芳香族化合物有(不考虑立体异构)( )
| A. | 6种 | B. | 14种 | C. | 16种 | D. | 18种 |
金属Ti(钛)是一种具有许多优良性能的较为昂贵的金属,钛和钛合金被认为是21世纪的重要金属材料。某化学兴趣小组用实验探究Ti、Mg、Cu的活泼性顺序。他们在相同温度下,取大小相同的三种金属薄片,分别投入等体积等浓度的足量稀硫酸中,观察现象如下:
下列有关三种金属的说法正确的是( )
金属 | Ti | Mg | Cu |
金属表面现象 | 放出气泡速度缓慢 | 放出气泡速度快 | 无变化 |
A.在地壳中的含量Mg > Ti,说明金属在地壳中的含量越低,活泼性越弱
B.反应中产生H2速率不同的原因是因为c(H+)不同
C.用Ti从CuSO4溶液中置换出Cu是工业制取Cu的很好途径
D.利用电解装置,Cu可以与稀硫酸反应产生H2


 .
.