题目内容
某学习小组通过测定大理石与硝酸反应过程中体系质量的变化,研究影响反应速率的因素.所用HNO3浓度为1.00mol/L、2.00mol/L,大理石有细颗粒与粗颗粒两种规格,实验温度为298K、308K,每次实验HNO3的用量均为25.0mL、大理石用量均为10.00g.
(1)请完成以下实验设计:
(2)实验①中CO2质量随时间变化的关系见下图:
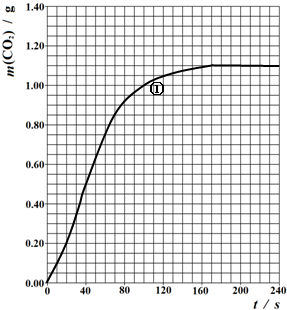
忽略溶液体积变化,计算实验①在40s-100s范围内HNO3的平均反应速率(保留2位小数):
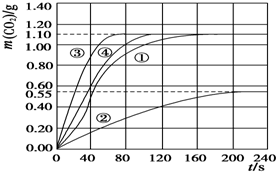
(3)请在答题纸上,画出实验②和③中CO2质量随时间变化关系的预期结果示意图.
(1)请完成以下实验设计:
| 实验目的 | 实验编号 | T/K | 大理石规格 | c(HNO3) mol/L |
| (Ⅰ)实验①和②探究HNO3浓度对该反应速率的影响; (Ⅱ)实验①和③探究温度对该反应速率的影响; (Ⅲ)实验①和④探究大理石规格(粗、细)对该反应速率的影响;) |
① | 298 | 粗颗粒 | 2.00 |
| ② | ||||
| ③ | ||||
| ④ |

忽略溶液体积变化,计算实验①在40s-100s范围内HNO3的平均反应速率(保留2位小数):
0.015mol?L-1?S-1
0.015mol?L-1?S-1
.(3)请在答题纸上,画出实验②和③中CO2质量随时间变化关系的预期结果示意图.
分析:(1)根据实验的目的和影响化学反应速率的因素来设计实验;
(2)由CO2质量随时间变化的关系图得出40-100s二氧化碳的增加量,再根据方程式计算硝酸的量,然后计算实验①在40-100s范围内HNO3的平均反应速率;
(3)根据②、③的硝酸用量及温度、大理石规格,对比①画出实验②和③中CO2质量随时间变化关系的预期结果示意图.
(2)由CO2质量随时间变化的关系图得出40-100s二氧化碳的增加量,再根据方程式计算硝酸的量,然后计算实验①在40-100s范围内HNO3的平均反应速率;
(3)根据②、③的硝酸用量及温度、大理石规格,对比①画出实验②和③中CO2质量随时间变化关系的预期结果示意图.
解答:解:(1)由实验目的可知,探究浓度、接触面积对化学反应速率的影响,
则实验①②的温度、大理石规格相同,只有浓度不同;实验①③中只有温度不同,其它条件必须相同;实验①④中只有大理石规格不同,其它条件完全相同,
故答案为:
(2)由图可知40-100s,CO2生成的质量为m(CO2)=1.00g-0.50g=0.50g,物质的量为n(CO2)=
mol≈0.0114mol,
由
CaCO3+HNO3═
Ca(NO3)2+
CO2↑+
H2O可知,消耗HNO3的物质的量为n(HNO3)=0.0114mol×2=0.0228,
又溶液体积为25ml=0.025L,所以HNO3减少的浓度△c(HNO3)=
=0.912mol?L-1,
反应的时间t=100s-40s=60s
所以HNO3在70-90S范围内的平均反应速率为v(HNO3)=
=
≈0.015mol?L-1?S-1,
故答案为:0.015mol?L-1?S-1;
(3)由于②硝酸浓度是①的一半,所以反应速率比①小,生成的二氧化碳是①的一半;
③中的硝酸浓度与①相同,所以生成的二氧化碳物质的量相等,但是温度③最高,反应速率最快,
根据以上画出实验②和③中CO2质量随时间变化关系的预期结果示意图为:
 ,
,
故答案为: .
.
则实验①②的温度、大理石规格相同,只有浓度不同;实验①③中只有温度不同,其它条件必须相同;实验①④中只有大理石规格不同,其它条件完全相同,
故答案为:
| 实验编号 | T/K | 大理石规格 | HNO3浓度/mol?L-1 |
| ② | 298 | 粗颗粒 | 1.00 |
| ③ | 308 | 粗颗粒 | 2.00 |
| ④ | 298 | 细颗粒 | 2.00 |
| 0.50 |
| 44 |
由
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
又溶液体积为25ml=0.025L,所以HNO3减少的浓度△c(HNO3)=
| 0.0228mol |
| 0.025L |
反应的时间t=100s-40s=60s
所以HNO3在70-90S范围内的平均反应速率为v(HNO3)=
| △c |
| △t |
| 0.912mol?L-1 |
| 60s |
故答案为:0.015mol?L-1?S-1;
(3)由于②硝酸浓度是①的一半,所以反应速率比①小,生成的二氧化碳是①的一半;
③中的硝酸浓度与①相同,所以生成的二氧化碳物质的量相等,但是温度③最高,反应速率最快,
根据以上画出实验②和③中CO2质量随时间变化关系的预期结果示意图为:
 ,
,故答案为:
 .
.点评:本题考查化学反应速率的影响因素及反应速率的计算,注意信息中提高的条件及图象的分析是解答的关键,较好的考查学生综合应用知识的能力.

练习册系列答案
相关题目

 (2011?万州区一模)硫酸工厂周围的空气中有较多的二氧化硫.某研究性学习小组为了测定空气(内含N2、O2、CO2、SO2等)中二氧化硫的体积分数设计了如下实验方案,如图是他们在测定中使用的部分装置图.
(2011?万州区一模)硫酸工厂周围的空气中有较多的二氧化硫.某研究性学习小组为了测定空气(内含N2、O2、CO2、SO2等)中二氧化硫的体积分数设计了如下实验方案,如图是他们在测定中使用的部分装置图. (2013?崇明县一模)某学习小组的三位同学为测定镀锌铁皮的镀层的厚度,提出了各自的设计方案.(忽略锌镀层的氧化)
(2013?崇明县一模)某学习小组的三位同学为测定镀锌铁皮的镀层的厚度,提出了各自的设计方案.(忽略锌镀层的氧化)