题目内容
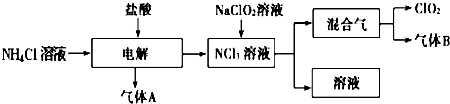
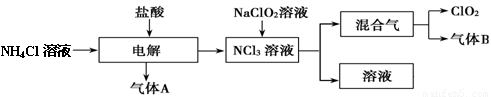
世界环保联盟建议全面禁止使用氯气用于饮用水的消毒,而建议采用高效“绿色”消毒剂二氧化氯。二氧化氯是一种极易爆炸的强氧化性气体,易溶于水、不稳定、呈黄绿色,在生产和使用时必须尽量用稀有气体进行稀释,同时需要避免光照、震动或受热。实验室以电解法制备ClO2的流程如下:
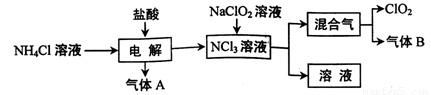
(1)ClO2中所有原子 (填“是”或“不是”)都满足8电子结构。上图所示方法制得的混合气中杂质气体B能使石蕊试液显蓝色,除去该杂质气体可选用 __;
A.饱和食盐水 B.碱石灰 C.浓硫酸 D.蒸馏水
(2)稳定性二氧化氯是为推广二氧化氯而开发的新型产品。下列说法正确的是 ;
A.二氧化氯可广泛用于工业和饮用水处理
B.应用在食品工业中能有效地延长食品贮藏期
C.稳定性二氧化氯的出现大大增加了二氧化氯的使用范围
D.在工作区和成品储藏室内,要有通风装置和监测及警报装置
(3)欧洲国家主要采用氯酸钠氧化浓盐酸制备,但该方法缺点是产率低、产品难以分离,还可能污染环境。写出该方法发生的化学方程式 ;
(4)我国广泛采用经干燥空气稀释的氯气与固体亚氯酸钠(NaClO2)反应制备,化学方程式是
,此法相比欧洲方法的优点是
(5)科学家又研究出了一种新的制备方法,利用硫酸酸化的草酸(H2C2O4)溶液还原氯酸钠,化学反应方程式为 ,此法提高了生产及储存、运输的安全性,原因是____ 。
(1)不是(1分) C(1分)
(2)A、B、C、D (全选给3分,漏选给2分)
(3)2NaClO3+4HCl(浓) = 2NaCl+Cl2↑+2ClO2↑+2H2O (2分)
(4)2NaClO2+Cl2 = 2NaCl+2ClO2 (2分)
产率高,易于分离,没有产生毒副产品 (2分)
(5)H2C2O4+2NaClO3+H2SO4= Na2SO4+2CO2↑+2ClO2↑+2H2O (2分)
反应过程中生成的二氧化碳起到稀释作用 (2分)
【解析】
试题分析:(1)对于共价化合物元素化合价绝对值+元素原子的最外层电子层=8,则该元素原子满足8电子结构,中Cl元素化合价为+4,Cl原子最外层电子数为7,所以4+7=11,Cl原子不满足8电子结构;据此判断ClO2中所有原子不是都满足8电子结构。混合气中杂质气体B能使石蕊试液显蓝色,说明是氨气。A、ClO2易溶于水,不能利用饱和食盐水吸收氨气,故A错误;B、碱石灰不能吸收氨气,故B错误;C、浓硫酸可以吸收氨气,且不影响ClO2,故C正确;D、ClO2易溶于水,不能利用水吸收氨气,故D错误。
(2)A.二氧化氯可广泛用于工业和饮用水处理,代替氯气,为“绿色”消毒剂,故A正确;B.应用在食品工业中能有效地延长食品贮藏期,能杀菌消毒,故B正确;C.稳定性二氧化氯的出现大大增加了二氧化氯的使用范围,便于运输和应用,故C正确;D.二氧化氯是一种极易爆炸的强氧化性气体,在工作区和成品储藏室内,要有通风装置和监测及警报装,故D正确;故答案为:A、B、C、D;
(3)氯酸钠氧化浓盐酸生成氯化钠、氯气、二氧化氯、水,该反应为2NaClO3+4HCl(浓)═2NaCl+Cl2↑+2ClO2↑+2H2O。
(4)氯气与固体亚氯酸钠(NaClO2)反应,生成氯化钠和二氧化氯,该反应为2NaClO2+Cl2═2NaCl+2ClO2,该法相比欧洲方法的优点为安全性好,没有产生毒副产品。
(5)用硫酸酸化的草酸(H2C2O4)溶液还原氯酸钠,反应生成硫酸钠、二氧化碳、二氧化氯、水,该反应为H2C2O4+2NaClO3+H2SO4═Na2SO4+2CO2↑+2ClO2↑+2H2O,此法提高了生产及储存、运输的安全性,原因是反应过程中生成的二氧化碳起到稀释作用。
考点:考查二氧化氯的性质及应用。