题目内容
12.下列离子方程式中正确的是( )| A. | 将少量SO2气体通入NaClO溶液中:SO2+2ClO-+H2O═SO32-+2HClO | |
| B. | Fe3O4溶解在过量的稀硝酸中:Fe3O4+8H+═Fe2++2Fe3++4H2O | |
| C. | NH4Al(SO4)2溶液与过量的Ba(OH)2溶液混合:NH4++Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+Al(OH)3↓+NH3•H2O | |
| D. | 向NaAlO2溶液中通入少量CO2:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- |
分析 A.次氯酸根离子能够氧化二氧化硫生成硫酸根离子;
B.硝酸具有强的氧化性,能够氧化二价铁离子生成三价铁离子;
C.氢氧化钡过量,铝离子反应生成偏铝酸根离子;
D.二氧化碳少量,反应生成氢氧化铝沉淀和碳酸钠.
解答 解:A.将少量SO2气体通入NaClO溶液的离子反应为SO2+H2O+2ClO-=SO42-+H++Cl-+HClO,故A错误;
B.Fe3O4溶解在过量的稀硝酸的离子反应为:3Fe3O4+NO3-+28H+═9Fe3++14H2O+NO↑,故B错误;
C.NH4Al(SO4)2溶液中加入过量Ba(OH)2溶液的离子反应为NH4++Al3++2SO42-+2Ba2++5OH-═2BaSO4↓+NH3•H2O+AlO2-+2H2O,故C错误;
D.向NaAlO2溶液中通入少量CO2离子反应为:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32-,故D正确;
故选:D.
点评 本题考查了离子方程式的书写方法和注意问题,注意离子反应顺序及量的多少对反应的影响是解题关键,题目难度较大.

练习册系列答案
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案
相关题目
7.下列变化中,不属于化学变化的是( )
| A. | 氯水使有色布条褪色 | B. | 漂白粉使某些染料褪色 | ||
| C. | SO2使品红溶液褪色 | D. | 活性炭使红墨水褪色 |
4.室温下,下列溶液粒子浓度关系正确的是( )
| A. | Na2S 溶液:c( Na+ )>c(HS- )>c( OH- )>c(H2S) | |
| B. | Na2C2O4 溶液:c ( OH- )=c ( H+ )+c(HC2O4-)+2c(H2C2O4) | |
| C. | Na2CO3溶液:c(Na+)+c(H+)=2c(CO32-)+c(OH-) | |
| D. | CH3COONa 和 CaCl2 混合溶液:c(Na+ )+c(Ca 2+ )═c(CH3COO- )+c(CH3COOH)+2c(Cl- ) |
2. 已知常温下氯酸钾与浓盐酸反应放出氯气,现按图进行卤素的性质实验.玻璃管内分别装有滴有不同溶液的白色棉球,反应一段时间后,对图中指定部分颜色描述正确的是( )
已知常温下氯酸钾与浓盐酸反应放出氯气,现按图进行卤素的性质实验.玻璃管内分别装有滴有不同溶液的白色棉球,反应一段时间后,对图中指定部分颜色描述正确的是( )
 已知常温下氯酸钾与浓盐酸反应放出氯气,现按图进行卤素的性质实验.玻璃管内分别装有滴有不同溶液的白色棉球,反应一段时间后,对图中指定部分颜色描述正确的是( )
已知常温下氯酸钾与浓盐酸反应放出氯气,现按图进行卤素的性质实验.玻璃管内分别装有滴有不同溶液的白色棉球,反应一段时间后,对图中指定部分颜色描述正确的是( )| 选项 | ① | ② | ③ | ④ |
| A | 黄绿色 | 白色 | 紫色 | 白色 |
| B | 黄绿色 | 橙色 | 紫色 | 黄绿色 |
| C | 黄绿色 | 橙色 | 蓝色 | 白色 |
| D | 黄绿色 | 橙色 | 蓝色 | 黄绿色 |
| A. | A | B. | B | C. | C | D. | D |

 ;
; ,D→E反应类型是加成反应.
,D→E反应类型是加成反应. 、
、 、
、 .
. .
.
 =O+RMgX→
=O+RMgX→ $\stackrel{H_{2}O}{→}$
$\stackrel{H_{2}O}{→}$ 现以乙烯和必要的无机物为原料合成2-丁醇,进而合成一种分子式为C6H8O4的具有六元环的物质J,合成线路如图,G中有两种不同化学环境的氢原子.
现以乙烯和必要的无机物为原料合成2-丁醇,进而合成一种分子式为C6H8O4的具有六元环的物质J,合成线路如图,G中有两种不同化学环境的氢原子.
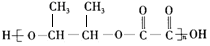 .
.