题目内容
10.由钠、镁、铝、铁四种金属中的两种组成的混合物12g,与足量的盐酸反应,产生0.5mol H2,则该混合物中一定不含( )| A. | Na | B. | Mg | C. | Al | D. | Fe |
分析 设均为+2价金属,由R+2HCl=RCl2+H2↑可知,R的物质的量等于气体的物质的量=0.5mol,金属的平均摩尔质量为:$\frac{12g}{0.5mol}$=24g/mol,结合平均值法及混合物有两种金属组成分析.
解答 解:设均为+2价金属,由R+2HCl=RCl2+H2↑可知,R的物质的量等于气体的物质的量=0.5mol,金属的平均摩尔质量为:$\frac{12g}{0.5mol}$=24g/mol,
则金属中一定含大于24g/mol的金属与小于24g/mol的金属,
由转化为+2价时Na、Mg、Al、Fe的摩尔质量分别为46g/mol、24g/mol、18g/mol、56g/mol,
由于为两种金属组成的混合物,而Mg的摩尔质量为24g/mol,则越大不含金属Mg,
故选B.
点评 本题考查化学反应方程式的计算,为高频考点,把握+2价金属与酸的反应、平均摩尔质量的计算为解答的关键,侧重分析与计算能力的考查,注意平均值法的应用,题目难度不大.

练习册系列答案
相关题目
20.篮烷结构式如图,其一氯取代产物的同分异构体数目是( )


| A. | 3种 | B. | 4种 | C. | 6种 | D. | 12 种 |
17.用下列实验装置进行相应实验,能达到实验目的是( )
| A. |  用图所示装置除去Cl2中含有的HCl | |
| B. | 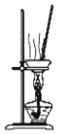 用图所示装置蒸干MgCl2饱和溶液制备MgCl2•6H2O晶体 | |
| C. |  用环己烷萃取碘水时将两者混合后需如图3所示用力振荡 | |
| D. |  继续煮沸图所示溶液至红褐色,停止加热,当光束通过体系时可产生丁达尔效应 |
5.已知常温下浓度为0.1mol•L-1的下列溶液的pH如下表所示:
下列有关说法不正确的是( )
| 溶质 | NaF | NaClO | NaHCO3 | Na2CO3 |
| pH | 7.5 | 9.7 | 8.2 | 11.6 |
| A. | pH=2的HF溶液与pH=12的NaOH溶液以体积比1:1混合,则有:c(Na+)>c(F-)>c(OH-)>c(H+) | |
| B. | 加热0.1 mol•L-1 NaClO溶液测其pH,pH大于9.7 | |
| C. | 0.1 mol•L-1 Na2CO3溶液中,存在关系:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) | |
| D. | 电离平衡常数大小关系:K(HF)>K(H2CO3 )>K(HClO)>K( HCO3-) |
15.漂白粉的主要成分是( )
| A. | NaClO | B. | CaCl2和 Ca(ClO)2 | C. | NaCl和NaClO | D. | Ca(ClO)2 |
2.下表中,对陈述I、II的正确性及两者间是否具有因果关系的判断都正确的是( )
| 选项 | 陈述I | 陈述II | 判断 |
| A | 碳酸钠溶液可用于治疗胃病 | Na2CO3可与盐酸反应 | I对,II对,有 |
| B | 盛放氢氧化钠溶液的试剂瓶用橡胶塞 | 氢氧化钠可以与玻璃中的二氧化硅反应生成粘性的硅酸钠 | I错,II 对,有 |
| C | 铝制品很耐腐蚀 | 铝在常温下很难被氧气氧化 | I对,II对,有 |
| D | 向漂白粉溶液中滴入少量白醋以增强漂白能力 | 醋酸的酸性比次氯酸强 | I对,II对,有 |
| A. | A | B. | B | C. | C | D. | D |
19.下列有关化学反应表达正确的是( )
| A. | 实验室用液溴和苯在催化剂作用下制溴苯: +Br2$\stackrel{FeBr_{3}}{→}$ +Br2$\stackrel{FeBr_{3}}{→}$ +HBr +HBr | |
| B. | 苯酚钠溶液中通入二氧化碳:2C6H5O-+CO2+H2O→2C6H5OH+CO32- | |
| C. | 向CH2BrCOOH中加入足量的氢氧化钠溶液并加热:CH2BrCOOH+OH-$\stackrel{△}{→}$CH2BrCOO-+H2O | |
| D. | 向氯乙烷水溶液中加入氢氧化钠溶液共热:CH3CH2Cl+NaOH$\stackrel{△}{→}$CH2=CH2+NaCl+H2O |


 中官能团的名称:碳碳双键、氯原子.
中官能团的名称:碳碳双键、氯原子. 所表示物质的名称是:2-甲基戊烷.
所表示物质的名称是:2-甲基戊烷. .
.