题目内容
 Ⅰ有A、B、C、D、E五种短周期元素,它们的原子序数依次增大,A元素的原子是半径最小的原子.B元素的最高价氧化物的水化物与其氢化物反应生成一种盐X,D与A同族,且与E同周期,E元素的最外层电子数是次外层电子数的
Ⅰ有A、B、C、D、E五种短周期元素,它们的原子序数依次增大,A元素的原子是半径最小的原子.B元素的最高价氧化物的水化物与其氢化物反应生成一种盐X,D与A同族,且与E同周期,E元素的最外层电子数是次外层电子数的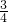 倍.A、B、D、E这四种元素,每一种都能与C元素形成原子个数比不相同的多种化合物.回答下列问题:
倍.A、B、D、E这四种元素,每一种都能与C元素形成原子个数比不相同的多种化合物.回答下列问题:
(1)写出相应元素符合,A______B______ C______ E______
(2)由A、C、D、E四种元素所组成的一种中学常见的化合物,它既能与盐酸反应,又能与NaOH溶液反应,在这种化合物的水溶液中,滴入紫色石蕊试液出现红色,则溶液中离子浓度由大到小的排列顺序为:______.
(3)将铝片和镁片.插入由A、C、D三种元素组成物质的稀溶液中构成原电池,则负极的电极反应式为______.
Ⅱ已知X是一种盐,H是常见金属单质,F、I是常见非金属单质,E、G都是工业上重要的碱性物质,它们有右图所示的关系.
试回答下列问题
(1)G的化学式为:______.
(2)写出下列反应的化学方程式
①______ ②______.
解:Ⅰ、A元素的原子是半径最小的原子,应为H元素,B元素的最高价氧化物的水化物与其氢化物反应生成一种盐X,则B为N元素,对应的盐为NH4NO3,E元素的最外层电子数是次外层电子数的 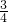 倍,应为S元素,D与A同族,且与E同周期,应为Na元素,A、B、D、E这四种元素,每一种都能与C元素形成原子个数比不相同的多种化合物,则C应为O元素;
倍,应为S元素,D与A同族,且与E同周期,应为Na元素,A、B、D、E这四种元素,每一种都能与C元素形成原子个数比不相同的多种化合物,则C应为O元素;
(1)由以上分析可知,A为H,B为N,C为O,E为S,故答案为:H,N,O,S;
(2)由A、C、D、E四种元素所组成的一种中学常见的化合物,它既能与盐酸反应,又能与NaOH溶液反应,
则该盐为NaHSO3,滴入紫色石蕊试液出现红色,说明HSO3-电离程度大于水解程度,则有c(H+)>c(OH-),
溶液中还存在水的电离,则c(H+)>c(SO32-),而HSO3-电离程度较小,则c(HSO3-)>c(H+),
所以有c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-),
故答案为:c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-);
(3)将铝片和镁片.插入由A、C、D三种元素组成物质为NaOH的稀溶液中构成原电池,铝做负极失电子发生氧化反应,镁做正极,溶液中氢离子得到电子生成氢气,则负极的电极反应式为:2Al-6e-+8OH-=2AlO2-+4H2O;故答案为:2Al-6e-+8OH-=2AlO2-+4H2O;
Ⅱ、由H是一种常见的金属单质,它在B中燃烧后生成一种非金属单质,我们可以推 知这种常见金属单质为金属镁,它在
CO2气体中燃烧生成C这种非金属单质.则A为 氧化镁;由X是一种盐,它受热分解可以产生MgO,因此X 可能为碳酸盐,但碳酸镁分解的产物只有氧化镁和二氧化碳,框图中的分解产物有三种,再由题示信息B(CO2)与D反应 可产生非金属单质F,且生成的E物质是工业上重要的碱,则可推断F是O2,D是Na2O2,E是Na2CO3,相应地推断出C是H2O,G是NaOH,那么X是一种碱式碳酸镁.
(1)由以上分析可知,G的化学式分别为NaOH,故答案为:NaOH;
(2)CO2与Na2O2反应生成2Na2CO3和O2,CO2与Mg反应生成MgO和C,
反应的方程式分别为2Na2O2+2CO2=2Na2CO3+O2和2Mg+CO2 2MgO+C,
2MgO+C,
故答案为:2Na2O2+2CO2=2Na2CO3+O2; 2Mg+CO2 2MgO+C.
2MgO+C.
分析:Ⅰ、A元素的原子是半径最小的原子,应为H元素,B元素的最高价氧化物的水化物与其氢化物反应生成一种盐X,则B为N元素,对应的盐为NH4NO3,E元素的最外层电子数是次外层电子数的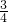 倍,应为S元素,D与A同族,且与E同周期,应为Na元素,A、B、D、E这四种元素,每一种都能与C元素形成原子个数比不相同的多种化合物,则C应为O元素;
倍,应为S元素,D与A同族,且与E同周期,应为Na元素,A、B、D、E这四种元素,每一种都能与C元素形成原子个数比不相同的多种化合物,则C应为O元素;
Ⅱ、由H是一种常见的金属单质,它在B中燃烧后生成一种非金属单质,我们可以推 知这种常见金属单质为金属镁,它在CO2气体中燃烧生成C这种非金属单质.则A为 氧化镁;由X是一种盐,它受热分解可以产生MgO,因此X 可能为碳酸盐,但碳酸镁分解的产物只有氧化镁和二氧化碳,框图中的分解产物有三种,再由题示信息B(CO2)与D反应 可产生非金属单质F,且生成的E物质是工业上重要的碱,则可推断F是O2,D是Na2O2,E是Na2CO3,相应地推断出C是H2O,G是NaOH,那么X是一种碱式碳酸镁.
点评:本题考查物质的推断,题目难度较大,涉及多个角度的考查,注意把握元素和物质推断的角度.
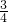 倍,应为S元素,D与A同族,且与E同周期,应为Na元素,A、B、D、E这四种元素,每一种都能与C元素形成原子个数比不相同的多种化合物,则C应为O元素;
倍,应为S元素,D与A同族,且与E同周期,应为Na元素,A、B、D、E这四种元素,每一种都能与C元素形成原子个数比不相同的多种化合物,则C应为O元素;(1)由以上分析可知,A为H,B为N,C为O,E为S,故答案为:H,N,O,S;
(2)由A、C、D、E四种元素所组成的一种中学常见的化合物,它既能与盐酸反应,又能与NaOH溶液反应,
则该盐为NaHSO3,滴入紫色石蕊试液出现红色,说明HSO3-电离程度大于水解程度,则有c(H+)>c(OH-),
溶液中还存在水的电离,则c(H+)>c(SO32-),而HSO3-电离程度较小,则c(HSO3-)>c(H+),
所以有c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-),
故答案为:c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-);
(3)将铝片和镁片.插入由A、C、D三种元素组成物质为NaOH的稀溶液中构成原电池,铝做负极失电子发生氧化反应,镁做正极,溶液中氢离子得到电子生成氢气,则负极的电极反应式为:2Al-6e-+8OH-=2AlO2-+4H2O;故答案为:2Al-6e-+8OH-=2AlO2-+4H2O;
Ⅱ、由H是一种常见的金属单质,它在B中燃烧后生成一种非金属单质,我们可以推 知这种常见金属单质为金属镁,它在
CO2气体中燃烧生成C这种非金属单质.则A为 氧化镁;由X是一种盐,它受热分解可以产生MgO,因此X 可能为碳酸盐,但碳酸镁分解的产物只有氧化镁和二氧化碳,框图中的分解产物有三种,再由题示信息B(CO2)与D反应 可产生非金属单质F,且生成的E物质是工业上重要的碱,则可推断F是O2,D是Na2O2,E是Na2CO3,相应地推断出C是H2O,G是NaOH,那么X是一种碱式碳酸镁.
(1)由以上分析可知,G的化学式分别为NaOH,故答案为:NaOH;
(2)CO2与Na2O2反应生成2Na2CO3和O2,CO2与Mg反应生成MgO和C,
反应的方程式分别为2Na2O2+2CO2=2Na2CO3+O2和2Mg+CO2
 2MgO+C,
2MgO+C,故答案为:2Na2O2+2CO2=2Na2CO3+O2; 2Mg+CO2
 2MgO+C.
2MgO+C.分析:Ⅰ、A元素的原子是半径最小的原子,应为H元素,B元素的最高价氧化物的水化物与其氢化物反应生成一种盐X,则B为N元素,对应的盐为NH4NO3,E元素的最外层电子数是次外层电子数的
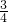 倍,应为S元素,D与A同族,且与E同周期,应为Na元素,A、B、D、E这四种元素,每一种都能与C元素形成原子个数比不相同的多种化合物,则C应为O元素;
倍,应为S元素,D与A同族,且与E同周期,应为Na元素,A、B、D、E这四种元素,每一种都能与C元素形成原子个数比不相同的多种化合物,则C应为O元素;Ⅱ、由H是一种常见的金属单质,它在B中燃烧后生成一种非金属单质,我们可以推 知这种常见金属单质为金属镁,它在CO2气体中燃烧生成C这种非金属单质.则A为 氧化镁;由X是一种盐,它受热分解可以产生MgO,因此X 可能为碳酸盐,但碳酸镁分解的产物只有氧化镁和二氧化碳,框图中的分解产物有三种,再由题示信息B(CO2)与D反应 可产生非金属单质F,且生成的E物质是工业上重要的碱,则可推断F是O2,D是Na2O2,E是Na2CO3,相应地推断出C是H2O,G是NaOH,那么X是一种碱式碳酸镁.
点评:本题考查物质的推断,题目难度较大,涉及多个角度的考查,注意把握元素和物质推断的角度.

练习册系列答案
相关题目
 有A、B、C、D、E五种短周期元素,它们的原子序数由A到E依次增大,已知A和B原子有相同的电子层数,且A的L层电子数是K层电子数的两倍,C在空气中燃烧时呈现黄色火焰,C的单质在高温下与B的单质充分反应,可以得到与E单质颜色相同的淡黄色固态化合物.D为原子核内有12个中子的二价金属,当2.4克D与盐酸反应时,在标准状况下放出气体2.24L.
有A、B、C、D、E五种短周期元素,它们的原子序数由A到E依次增大,已知A和B原子有相同的电子层数,且A的L层电子数是K层电子数的两倍,C在空气中燃烧时呈现黄色火焰,C的单质在高温下与B的单质充分反应,可以得到与E单质颜色相同的淡黄色固态化合物.D为原子核内有12个中子的二价金属,当2.4克D与盐酸反应时,在标准状况下放出气体2.24L.

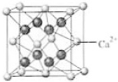 (4)B与Ca形成的晶体的晶胞如右图所示,其中Ca2+的配位数是
(4)B与Ca形成的晶体的晶胞如右图所示,其中Ca2+的配位数是