题目内容
【题目】某温度下,某反应达平衡时平衡常数K=c(C)·c(D)/c(A)·c(B)。恒容时,温度升高,C的物质的量浓度减小。下列说法正确的是( )
A. 该反应的焓变ΔH>0
B. 恒温恒容时,增大体系压强,c(D)一定增大
C. 升高温度,逆反应速率减小
D. 该反应的化学方程式可能为A(g)+B(g)![]() C(g)+D(g)
C(g)+D(g)
【答案】D
【解析】
由化学平衡常数的表达式可知该反应的方程式为A(g)+B(g)![]() C(g)+D(g),温度升高,C的浓度减小,说明平衡逆向移动,正反应为放热反应,ΔH<0,A项错误、D项正确;恒温恒容下,因该反应为等体积反应,向反应中通入和反应无关的气体,虽然增大压强,但对该反应的平衡无影响,D的浓度不变,B项错误;升高温度,正、逆反应速率都增大,C项错误。
C(g)+D(g),温度升高,C的浓度减小,说明平衡逆向移动,正反应为放热反应,ΔH<0,A项错误、D项正确;恒温恒容下,因该反应为等体积反应,向反应中通入和反应无关的气体,虽然增大压强,但对该反应的平衡无影响,D的浓度不变,B项错误;升高温度,正、逆反应速率都增大,C项错误。
综上所述,本题选D。

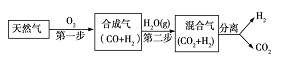
【题目】页岩气是从页岩层中开采出来的一种非常重要的天然气资源,页岩气的主要成分是甲烷,是公认的洁净能源。
(1)页岩气不仅能用作燃料,还可用于生产合成气(CO+H2)。CH4与H2O(g)通入聚焦太阳能反应器,发生反应:CH4(g)+ H2O(g)═CO(g)+3H2(g) ΔH。
已知:①CH4、H2、CO的燃烧热分别为a ![]() 、b
、b ![]() 、c
、c ![]() (a、b、c均大于0);
(a、b、c均大于0);
②水的汽化热为+d ![]() (d >0)。则ΔH=__________
(d >0)。则ΔH=__________![]() (用含a、b、c、d的代数式表示)。
(用含a、b、c、d的代数式表示)。
(2)用合成气制甲醇的反应为2H2(g)+CO(g)![]() CH3OH(g) ΔH,在10 L的恒容密闭容器中按物质的量之比1∶2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如图所示。
CH3OH(g) ΔH,在10 L的恒容密闭容器中按物质的量之比1∶2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如图所示。

①ΔH________(填“>”“<”或“=”)0。
②写出两条可同时提高反应速率和CO的转化率的措施:_______、_____。
③下列说法正确的是___________(填序号)。
A.温度越高,该反应的平衡常数越大
B.达平衡后再充入稀有气体,CO的转化率提高
C.体系内气体压强不再变化时,反应达到平衡状态
D.图中压强p1<p2
④200 ℃时,n(H2)随时间的变化如表所示,3 min时反应刚好达到平衡状态,请利用表中的数据计算0~3 min内v(CH3OH)=_______![]() 。
。
t/min | 0 | 1 | 3 | 5 |
n(H2)/mol | 8.0 | 5.4 | 4.0 | 4.0 |
⑤200℃时该反应的平衡常数K=____________。向上述200 ℃的平衡体系中再加入2 mol CO、2 mol H2、2 mol CH3OH,保持温度不变,则平衡_______(填“正向移动”“逆向移动”或“不移动”)。
(3)甲、氧气和KOH溶液可组成燃料电池。标准状况下通入5.6 L甲烷时,测得电路中转移1.96 mol电子,则甲烷的利用率为________。