题目内容
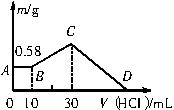
将NaOH、MgCl2、AlCl3的混合物溶于足量的水中,有0.58g沉淀生成,在所得浊液中加入0.5mol/L盐酸,加入盐酸的体积与生成沉淀的关系如图所示。
求混合物中NaOH、MgCl2、AlCl3的质量及D点盐酸的体积。
见分析
【试题分析】
解析:看A~B段,说明NaOH过量,发生反应:OH-+H+=H2O,可求得NaOH剩余10×10-3L×0.5mol/L=5×10-3mol,则0.58g沉淀应为Mg(OH)2即0.01mol,溶解Mg(OH)2需盐酸0.02mol(40mL)。
看B~C段,发生反应:Al
 +H++H2O=Al(OH)3↓,C点为Mg(OH)2和Al(OH)3的混合物。
+H++H2O=Al(OH)3↓,C点为Mg(OH)2和Al(OH)3的混合物。Al
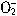 ―― Al(OH)3 ―― HCl
―― Al(OH)3 ―― HClx 20mL×0.5mol/L
可得:x=0.01mol,溶解Al(OH)3需要HCl60mL。
则D点盐酸的体积为30mL+40mL+60mL=130mL。
由于溶液中n(H+)=n(OH-),则NaOH的质量为130mL×0.5mol/L×40g/mol×10-3=2.6g。
同时可求得MgCl2的质量为0.01mol×95g/mol=0.95g。
AlCl3的质量为0.01mol×133.5g/mol=1.335g。

练习册系列答案
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案
相关题目
 ,它的含氧官能团名称为 、 。
,它的含氧官能团名称为 、 。  ,它的含氧官能团名称为 、 。
,它的含氧官能团名称为 、 。  ,它的含氧官能团名称为
、
。
,它的含氧官能团名称为
、
。  ,它的含氧官能团名称为
、
。
,它的含氧官能团名称为
、
。