题目内容
【题目】[物质结构与性质]
亚硝酸盐与钴(Ⅲ)形成的一种配合物1Co(NH3)5NO2]Cl2的制备流程如下:
![]()
(1)Co2+基态核外电子排布式为 。
(2)配合物1Co(NH3)5Cl]Cl2中与Co3+形成配位键的原子为 (填元素符号);配离子 1Co(NH3)5NO2]2+的配体中氮原子的杂化轨道类型为 。
(3)与NO2-互为等电子体的单质分子为 (写化学式)。
(4)H2O2与H2O可以任意比例互溶,除因为它们都是极性分子外,还因为 。

(5)亚硝酸盐在水体中可转化为强致癌物亚硝胺,亚硝胺NDMA的结构简式如图所示,1molNDMA分子中含有σ键的数目为 mol。
【答案】(1)1Ar]3d7或1s22s22p63s23p63d7(2分)
(2)N和Cl(共2分)sp2和sp3(共2分)(3)O3(2分)
(4)H2O2与H2O之间可以形成氢键(2分)(5)10(2分)
【解析】
试题解析:(1)Co2+核外有25个电子,基态核外电子排布式为1s22s22p63s23p63d7;(2)氮原子与氯离子提供孤电子对与Co3+形成配位键;Co(NH3)5NO2]2+的配体中氮原子的杂化轨道sp3;而NO2-中氮原子的杂化轨道类型为sp2;(3)NO2-的电子数为24,气等电子体为O3;(4)H2O2与H2O可以形成氢键,溶解度增大,导致二者之间互溶;(5)双键中一个∏键,一个σ键;1molNDMA分子中有6molC-H;2molC-N;1molN-N;1molN-Oσ键,共10摩尔;
考点:物质结构和性质;

 培优好卷单元加期末卷系列答案
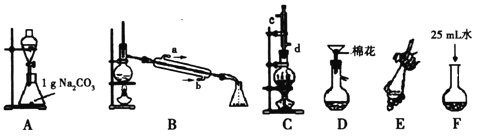
培优好卷单元加期末卷系列答案【题目】苯甲酸甲酯是一种重要的工业原料,某研究性学习小组的同学拟用下列装置制取高纯度的苯甲酸甲酯。
有关数据如下表:
熔点/℃ | 沸点/℃ | 密度/g·cm-3 | 水溶性 | |
苯甲酸 | 122.4 | 249 | 1.27 | 微溶 |
甲醇 | -97 | 64.3 | 0.79 | 互溶 |
苯甲酸甲酯 | -12.3 | 199.6 | 1.09 | 不溶 |
(1)在烧瓶中混合有机物及浓硫酸的方法是__________________________________,在实际实验中,甲醇、苯甲酸的物质的量之比远大于理论上物质的量之比,目的是_______________。装置C中除甲醇、苯甲酸与浓硫酸外还需要放置____________________________。
(2)B装置需加热的玻璃仪器的名称__________,C装置上部的冷凝管的主要作用是_____________________。冷却剂在冷凝管中的流动方向是__________。
(3)制备和提纯苯甲酸甲酯的操作先后顺序为(填装置字母代号)________________。
(4)A中Na2CO3的作用是_____________________;D装置的作用是_______________;当B装置中温度计显示_____________℃时可收集苯甲酸甲酯。




