题目内容
(10分)工业生产粗硅的反应有:
SiO2+2C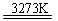 Si(粗)+2CO↑;SiO2+3C
Si(粗)+2CO↑;SiO2+3C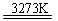 SiC+2CO↑。
SiC+2CO↑。
(1)若产品中粗硅与碳化硅的物质的量之比为1∶1,则参加反应的C 和SiO2的质量比为______________。
(2)粗硅进一步制备纯硅的原理如下:
Si(粗)+2Cl2(g) SiCl4(l); SiCl4+2H2
SiCl4(l); SiCl4+2H2 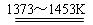 Si(纯)+4HCl。
Si(纯)+4HCl。
若上述反应中Si(粗 )和SiCl4的利用率均为80%,制粗硅时有10%的SiO2转化为SiC,则生产25.2吨纯硅需纯度为75%石英砂_______________吨。
)和SiCl4的利用率均为80%,制粗硅时有10%的SiO2转化为SiC,则生产25.2吨纯硅需纯度为75%石英砂_______________吨。
(3)工业上还可以通过如下图所示的流程制取纯硅:
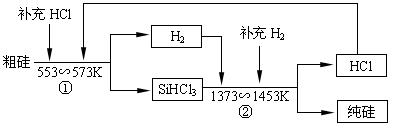
若反应①为:Si(粗)+3HCl(g)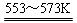 SiHCl3(l)+H2(g);
SiHCl3(l)+H2(g);
则反应②的化学方程式为___________________________________ 。
假设每一轮次生产过程中,硅元素没有损失,反应①中HCl的利用率为α1,反应②中H2的利用率为α2,,若制备1mol纯硅,在第二轮次的生产中,现补充投入HCl和H2的物质的量之比是5∶1。则α1与α2的代数关系式为____________________________。
SiO2+2C
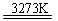 Si(粗)+2CO↑;SiO2+3C
Si(粗)+2CO↑;SiO2+3C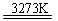 SiC+2CO↑。
SiC+2CO↑。(1)若产品中粗硅与碳化硅的物质的量之比为1∶1,则参加反应的C 和SiO2的质量比为______________。
(2)粗硅进一步制备纯硅的原理如下:
Si(粗)+2Cl2(g)
 SiCl4(l); SiCl4+2H2
SiCl4(l); SiCl4+2H2 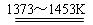 Si(纯)+4HCl。
Si(纯)+4HCl。若上述反应中Si(粗
 )和SiCl4的利用率均为80%,制粗硅时有10%的SiO2转化为SiC,则生产25.2吨纯硅需纯度为75%石英砂_______________吨。
)和SiCl4的利用率均为80%,制粗硅时有10%的SiO2转化为SiC,则生产25.2吨纯硅需纯度为75%石英砂_______________吨。(3)工业上还可以通过如下图所示的流程制取纯硅:

若反应①为:Si(粗)+3HCl(g)
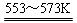 SiHCl3(l)+H2(g);
SiHCl3(l)+H2(g);则反应②的化学方程式为___________________________________ 。
假设每一轮次生产过程中,硅元素没有损失,反应①中HCl的利用率为α1,反应②中H2的利用率为α2,,若制备1mol纯硅,在第二轮次的生产中,现补充投入HCl和H2的物质的量之比是5∶1。则α1与α2的代数关系式为____________________________。
(10分)
(1)1∶2(2分)
(2)125t(3分)
(3)SiHCl3+H2 Si(纯)+3HCl (2分) 5α1= 3α2 + 2α1α2 (3分)
Si(纯)+3HCl (2分) 5α1= 3α2 + 2α1α2 (3分)
(1)1∶2(2分)
(2)125t(3分)
(3)SiHCl3+H2
 Si(纯)+3HCl (2分) 5α1= 3α2 + 2α1α2 (3分)
Si(纯)+3HCl (2分) 5α1= 3α2 + 2α1α2 (3分)略

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目

 )2溶液
)2溶液 但是它不与水、烧碱反应
但是它不与水、烧碱反应 缓慢通入足量二氧化碳,先产生浑浊后恢复澄清
缓慢通入足量二氧化碳,先产生浑浊后恢复澄清