题目内容
将0.2 mol·L-1的HCN溶液和0.1 mol·L-1的NaOH溶液等体积混合后,溶液显碱性,下列关系式中正确的是( )
| A.c(HCN)<c(CN-) | B.c(Na+)> c(CN-) |
| C.c(HCN)=c(CN-)= c(Na+) | D.c(HCN)+c(CN-)="0.2" mol·L-1 |
B
试题分析:HCN和NaOH反应后得到等浓度的HCN和NaCN的混合溶液。HCN是弱酸,电离是溶液显酸性。NaCN水解使溶液显碱性。现在溶液显碱性说明CN-的水解作用大于HCN的电离作用。所以c(CN-)<c(HCN);c(Na+)> c(CN-); c(HCN)+c(CN-)= 2c(Na+) ;c(HCN)+c(CN-)="0.2" mol/L÷2="0.1" mol/L.选项为:B。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 )均增大
)均增大 HCO3-+OH-,通入CO2,平衡朝正反应方向移动
HCO3-+OH-,通入CO2,平衡朝正反应方向移动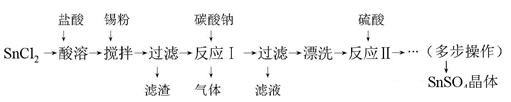



 CH3COO- + H3O+
CH3COO- + H3O+