题目内容
【题目】最近几年我国已加大对氮氧化物排放的控制力度。消除氮氧化物污染有多种方法。
(l)用CH4还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)= 4NO(g)+CO2(g)+2H2O(g) △H=-574kJ·mol-1
②CH4(g)+4NO (g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ·mol-1
③H2O(g)= H2O(l) △H=-44.0kJ·mol-1
CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(1)的热化学方程式为_________________。
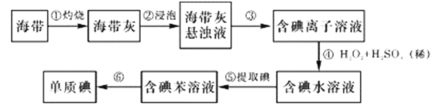
(2)用活性炭还原法也可处理氮氧化物。有关反应为:2C(s)+2NO2(g)=N2(g)+2CO2(g) △H<0,起始时向密闭容器中充入一定量的C(s)和NO2(g),在不同条件下,测得各物质的浓度变化状况如下图所示。

①010min内,以CO2表示的平均反应速率v(CO2)=_______________。
②0~10min,1020 min,3040 min三个阶段NO2的转化率分别为α1、α2、α3,其中最小的为_________,其值是___________________。
③计算反应达到第一次平衡时的平衡常数K=____________。
④第10min时,若只改变了影响反应的一个条件,则改变的条件为______(填选项字母)。
A.增加C(s)的量 B.减小容器体积 C.加入催化剂
⑤20~30min、4050 min时体系的温度分别为T1和T2,则T1_____T2(填“> “<”或“=”), 判断的理由是_________________________。
【答案】CH4(g ) +2NO2( g ) =N2( g )+ CO2(g ) +2H2O (l ) ΔH= -955 kJ/mol 0.02 mol/(L· min) α1 20% 0.675 C > 此反应为放热反应,降低温度,平衡向正反应方向移动
【解析】
(l)根据盖斯定律,方程式①+②-③×4可得目标方程式,反应热作相应变化即可。
(2)起始时向密闭容器中充入一定量的C(s)和NO2(g),发生反应:2C(s)+2NO2(g)=N2(g)+2CO2(g) △H<0,开始时NO2浓度逐渐降低,到10min时浓度降低得程度更大,说明反应速率变快,可能是使用了催化剂或升高了温度,20min时到达了平衡。30min时NO2浓度在原平衡基础上降低,生成物浓度在原平衡基础上增大,说明平衡向右移动,改变的条件可能是降低温度,不能是增大压强(若增大压强,体积变小,各物质浓度都增大)和改变碳(固体)或其他物质浓度(因为是在原平衡基础上变化的)。
(1)根据盖斯定律,方程式①+②-③×4可得目标方程式,反应热作相应变化,得到CH4(g ) +2NO2( g ) =N2( g )+ CO2(g ) +2H2O (l ) ΔH= -955 kJ/mol。
(2)①根据图像,10min时CO2的浓度为0.2mol/L,则以CO2表示的反应速率为![]() =0.02mol/(L·min)。
=0.02mol/(L·min)。
②根据图像,0~10min内,NO2的转化率α1=![]() =20%
=20%
10~20min内,NO2的转化率α2=![]() =50%
=50%
30~40min内,NO2的转化率α3=![]() =25%,所以转化率最小的是α1,为20%。
=25%,所以转化率最小的是α1,为20%。
③反应在20min时达到平衡,根据![]() 。
。
④根据图像,10~20min内反应速率加快,平衡仍正向移动。增加固体C不影响反应速率,A错;减小容器体积,则增大压强,各物质浓度会瞬间突然增大,B错;加入催化剂可加快反应速率,但不影响平衡,C正确。
⑤20~30min、4050 min是体系的两个平衡状态,由题意可知改变温度使平衡发生移动,4050 min时的平衡与20~30min时的平衡相比,平衡正向移动,因反应是放热反应,故降低温度平衡正向移动,T1>T2。

 精英口算卡系列答案
精英口算卡系列答案【题目】几种短周期元素的原子半径及主要化合价如表:
元素代号 | X | Y | Z | W | Q |
原子半径 | 160 | 143 | 70 | 66 | 104 |
主要化合价 |
|
|
|
|
|
下列选项正确的是( )
A.X、Y元素的金属性![]()
B.一定条件下,Z单质与W的常见单质直接生成![]()
C.Y的最高价氧化物对应的水化物能溶于氨水
D.Q与W形成的一种化合物可用作纸张漂白剂
【题目】有 A 、 B 、 C 、 D 、 E 、 F 六种元素,已知:
① 它们位于三个不同的短周期,核电荷数依次增大。
②E元素的电离能数据见下表(KJ/mol):
![]()
③B与F同主族。
④A、E 都能与 D 按原子个数比 1:1 和 2:1 形成化合物。
⑤B、C 都能与 D 按原子个数比 1:1 和 1:2 形成化合物。
(1)写出只含有 A、B、D、E 四种元素的两种无水盐的化学式:_______________________________
(2)B2A2 分子中存在______________ 个![]() 键,_____________个
键,_____________个![]() 键。
键。
(3)人们通常把拆开 1mol 某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可以用于计算化学反应的反应热(△H)化学反应的反应热等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。下表列出了上述部分元素形成的化学键的键能:
化学键 | F—D | F—F | B—B | F—B | B=D | D=D |
键能(KJ/mol) | 460 | 176 | 347.7 | 347 | 745 | 497.3 |
试计算1molF单质完全燃烧时的反应热△H=________(已知1molF单质中含2mol F—F键,1molFO2中含有4mol键F—O)。