题目内容
将pH=3的盐酸溶液和pH=11的氨水等体积混和后,溶液中离子浓度关系正确的是( )
分析:pH=3的盐酸溶液和pH=11的氨水中[H+]=[OH-],由于氨水为弱电解质,不能完全电离,则氨水浓度远大于盐酸浓度,反应后溶液呈碱性,以此进行判断.
解答:解:pH=3的盐酸的浓度为10-3 mol?L-1,而pH=11的氨水的浓度大约为0.1 molL-1远大于盐酸的浓度,故等体积混合后氨水过量,混合液中有
NH4Cl═NH4++Cl-①,NH3?H2O(过量的)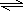 NH4++OH- ②,①式中c(NH4+)=c(Cl-)而溶液中c(NH4+)总是①、②两式电离出的c(NH4+)之和,
NH4++OH- ②,①式中c(NH4+)=c(Cl-)而溶液中c(NH4+)总是①、②两式电离出的c(NH4+)之和,
故c(NH4+)>c(Cl-),又氨水过量溶液呈碱性故c(OH-)>c(H+),而氨水为弱电解质,故电离的c(OH-)一定小于c(Cl-),
故选B.
NH4Cl═NH4++Cl-①,NH3?H2O(过量的)
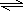 NH4++OH- ②,①式中c(NH4+)=c(Cl-)而溶液中c(NH4+)总是①、②两式电离出的c(NH4+)之和,
NH4++OH- ②,①式中c(NH4+)=c(Cl-)而溶液中c(NH4+)总是①、②两式电离出的c(NH4+)之和,故c(NH4+)>c(Cl-),又氨水过量溶液呈碱性故c(OH-)>c(H+),而氨水为弱电解质,故电离的c(OH-)一定小于c(Cl-),
故选B.
点评:本题考查离子浓度的大小比较,注意氨水为弱电解质的性质,从弱电解质的电离和盐类的水解的角度综合考虑解答该类题目.

练习册系列答案
相关题目
将pH=3的盐酸溶液和pH=11的氨水等体积混合后,溶液中离子浓度关系正确的是:( )
| A.c(NH4+)>c(Cl–)>c(H+)>c(OH–) | B.c(NH4+)>c(Cl–)>c(OH–)>c(H+) |
| C.c(Cl–)>c(NH4+)>c(H+)>c(OH–) | D.c(Cl–)>c(NH4+)>c(OH–)>c(H+) |