题目内容
【题目】一定温度时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,发生反应: PCl5(g) ![]() Cl2(g)+PCl3(g)经一段时间后反应达到平衡。反应过程中测得的部分数据见下表:
Cl2(g)+PCl3(g)经一段时间后反应达到平衡。反应过程中测得的部分数据见下表:
反应时间/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
(1)能表明该反应达到平衡状态的是________(填序号);
A.生成1molPCl3的同时生成1molPCl5 B.混合气体的平均相对分子质量不变
C.PCl5、Cl2、PCl3三者的浓度比值1:1:1 D.混合气体的密度不变
(2)上述温度下,达到平衡时,PCl5的转化率为____;该反应的平衡常数K= ___。
(3)反应在前50 s内的平均速率为v(PCl3)=_____。
(4)保持其他条件不变,若升高温度,反应重新达到平衡,平衡时c(PCl3)=0.11moI·L-l,则正反应的ΔH__0(填“>”或“<”)。
(5)相同温度下,若起始时向容器中充入1.0 molPCl5、0.20mol PCl3和0.20 mol Cl2,则反应达到平衡前v(正) __ v(逆)(填“>”或“<”)
【答案】A、B 20% 0.025 mol/L 1.6×10-3 mol/(L·s) > >
【解析】
(1)根据化学平衡的特征和本质反分析判断;
(2)利用三段式,结合转化率的概念和平衡常数K=![]() 计算;
计算;
(3)根据v=![]() =
=![]() 计算v(PCl3);
计算v(PCl3);
(4)由表中数据可知,平衡时n(PCl3)=0.2mol,保持其他条件不变,升高温度,新平衡时c(PCl3)=0.11 mol/L,则n′(PCl3)=0.22mol>0.2mol,结合温度对平衡的影响分析判断;
(5)首先计算浓度商Qc,再根据Qc和K的大小关系分析判断。
(1)A.生成1molPCl3的同时生成1molPCl5,表示正逆反应速率相等,说明反应达到平衡状态,故A正确;B.该反应为气体的物质的量增大的反应,混合气体的质量不变,则混合气体的平均相对分子质量为变量,当混合气体的平均相对分子质量不变,表明反应达到平衡状态,故B正确;C.PCl5、Cl2、PCl3三者的浓度比值1∶1∶1,不能说明浓度是否不变,不能说明反应达到平衡状态,故C错误;D.混合气体的质量和体积不变,混合气体的密度始终不变,不能说明反应达到平衡状态,故D错误;故答案为:AB;
(2)相同温度下,向容器中再充入1.0molPCl5,根据表格数据,平衡时n(PCl3)=0.2mol,则
PCl5(g)PCl3(g)+Cl2(g)
起始量(mol/L) 0.5 0 0
变化量(mol/L)0.1 0.1 0.1
平衡量(mol/L)0.4 0.1 0.1
平衡时PCl5转化率=![]() ×100%=20%,平衡常数K=
×100%=20%,平衡常数K=![]() =0.025,故答案为:20%;0.025;
=0.025,故答案为:20%;0.025;
(3)由表中数据可知50s内,△n(PCl3)=0.16mol,v(PCl3)=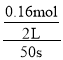 =0.0016mol/(Ls),故答案为:0.0016mol/(Ls);
=0.0016mol/(Ls),故答案为:0.0016mol/(Ls);
(4)由表中数据可知,平衡时n(PCl3)=0.2mol,保持其他条件不变,升高温度,新平衡时c(PCl3)=0.11 mol/L,则n′(PCl3)=0.11 mol/L×2L=0.22mol>0.2mol,说明升高温度,平衡正向移动,正反应为吸热反应,即△H>0,故答案为:>;
(5)相同温度下,平衡常数K相同。起始时向容器中充入1.0 mol PCl5、0.20 molPCl3和0.20 molCl2,起始时PCl5的浓度为0.5mol/L、PCl3的浓度为0.1mol/L、Cl2的浓度为0.1mol/L,浓度商Qc=![]() =0.02<K=0.025,说明反应向正反应方向进行,反应达平衡前v(正)>v(逆),故答案为:>。
=0.02<K=0.025,说明反应向正反应方向进行,反应达平衡前v(正)>v(逆),故答案为:>。

 名校课堂系列答案
名校课堂系列答案【题目】某研究性学习组利用H2C2O4溶液和酸性KMnO4溶液之间的反应来探究“外界条件改变对化学反应速率的影响”,实验如下:(已知H2C2O4是弱酸)
实验 序号 | 实验 温度 | KMnO4溶液 | H2C2O4溶液 | H2O | 溶液褪色时间 | ||
V(mL) | c(mol/L) | V(mL) | c(mol/L) | V(mL) | t(s) | ||
A | 293K | 2 | 0.05 | 8 | 0.25 | 0 | t1 |
B | T1 | 2 | 0.05 | 6 | 0.25 | V1 | 8 |
C | 313K | 2 | 0.05 | 6 | 0.25 | 2 | t2 |
(1)通过实验A、B,可探究出___的改变对反应速率的影响,其中
(2)通过实验____可探究出温度变化对化学反应速率的影响。
(3)若t1<8,则由实验A、B可以得出的结论是____;利用实验B中数据计算,从反应开始到有结束,用KMnO4的浓度变化表示的反应速率为______。
(4)该反应中有无色无味气体产生,且锰被还原为Mn2+,写出相应反应的离子方程式 ________。
(5)该小组的一位同学通过查阅资料发现:反应一段时间后该反应速率会加快,造成此种变化的原因是反应体系中的某种粒子对KMnO4与H2C2O4之间的反应有某种特殊的作用,则该作用是 ____。