题目内容
X、Y、Z、U、V是元素周期表前四周期中的五种常见元素,其相关信息如下表:
请回答下列问题:
(1)元素X位于周期表中第 周期第 族,其离子结构示意图为 。
(2)上述元素中最高价氧化物对应的水化物酸性最强的是 (写化学式),非金属气态氢化物还原性最强的是 (写化学式)。
(3)在碱性条件下,Y的单质可与UO2-反应制备一种可用于净水的盐UO42-,该反应的离子方程式是 。
(4)我国首创的海洋电池被大规模用于海洋灯塔。该电池是以X板为负极,铂网为正极,海水为电解质溶液,电池总反应为:4X+3O2+6H2O=4X(OH)3。该电池正极反应为 。
(5)已知25℃时,Ksp[U(OH)3]=2.63×10-39,则该温度下反应U(OH)3+3H+ U3++3H2O的平衡常数K= 。
U3++3H2O的平衡常数K= 。
| 元素 | 相关信息 |
| X | 地壳中含量最多的金属,其氧化物可用作耐火材料 |
| Y | 单质在常温常压下为黄绿色气体 |
| Z | 常温常压下,单质是淡黄色固体,常在火山口附近沉积 |
| U | 常温下单质遇浓硫酸钝化,其一种核素的质量数为56,中子数为30 |
| V | 属短周期元素,原子的最外层电子数是内层电子数的2/5 |
请回答下列问题:
(1)元素X位于周期表中第 周期第 族,其离子结构示意图为 。
(2)上述元素中最高价氧化物对应的水化物酸性最强的是 (写化学式),非金属气态氢化物还原性最强的是 (写化学式)。
(3)在碱性条件下,Y的单质可与UO2-反应制备一种可用于净水的盐UO42-,该反应的离子方程式是 。
(4)我国首创的海洋电池被大规模用于海洋灯塔。该电池是以X板为负极,铂网为正极,海水为电解质溶液,电池总反应为:4X+3O2+6H2O=4X(OH)3。该电池正极反应为 。
(5)已知25℃时,Ksp[U(OH)3]=2.63×10-39,则该温度下反应U(OH)3+3H+
 U3++3H2O的平衡常数K= 。
U3++3H2O的平衡常数K= 。(16分)
(1)三、ⅢA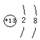 (3分,每空1分)
(3分,每空1分)
(2)HClO4 SiH4 (4分,每空2分)
(3)2FeO2-+ 3Cl2 + 8OH- = 2FeO42-+ 6Cl-+ 4H2O (3分)
(4)O2+4e-+2H2O=4OH-或3O2+12e-+6H2O=12OH- (3分)
(5)2.63×103 (3分,带单位计算也给分)
(1)三、ⅢA
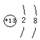 (3分,每空1分)
(3分,每空1分)(2)HClO4 SiH4 (4分,每空2分)
(3)2FeO2-+ 3Cl2 + 8OH- = 2FeO42-+ 6Cl-+ 4H2O (3分)
(4)O2+4e-+2H2O=4OH-或3O2+12e-+6H2O=12OH- (3分)
(5)2.63×103 (3分,带单位计算也给分)
试题分析:(1)地壳中含量最多的金属元素是铝,则X是Al,铝原子具有283的电子层结构,位于第三周期第IIIA族;1个氯原子失去3个电子变为铝离子,则Al3+的核电荷数为13,具有28电子层结构;(2)氯气在常温常压下是黄绿色气体,则Y是氯元素,其最高价氧化物对应水化物是高氯酸,HClO4是已知酸中酸性最强的酸;硫磺在常温常压下是淡黄色固体,则Z为硫元素;由于质子数=质量数—中子数=56—30=26,则U为铁元素;短周期元素原子的内层电子数可能是2或10,最外层电子数是内层电子数的2/5,说明电子层结构为284,则V是硅元素;根据元素周期律可知,非金属性:Si<S<Cl,则单质的氧化性:Si<S<Cl2,气态氢化物的还原性:SiH4>H2S>HCl;(3)Cl2是强氧化剂,能将FeO2-氧化为FeO42-,氯由0降为-1价,铁由+3价升为+6价,根据化合价升降总数相等、电荷守恒、原子守恒可得:2FeO2-+ 3Cl2 + 8OH-= 2FeO42-+ 6Cl-+ 4H2O;(4)4Al+3O2+6H2O=4Al(OH)3,铝由0升为+3价,失去电子,发生氧化反应,说明铝作负极;氧由0降为—2价,得到电子,发生还原反应,说明氧气是正极反应物,根据电子、电荷、原子守恒可知,正极反应式为O2+4e-+2H2O=4OH-或3O2+12e-+6H2O=12OH-;(5)25℃时,Ksp[Fe(OH)3]=2.63×10-39,Kw=1.0×10-14,Fe(OH)3+3H+
 Fe3++3H2O,固体和纯液体不能写入平衡常数表达式,则该反应的平衡常数K=c(Fe3+)/c3(H+)=[c(Fe3+)?c3(OH-)]/[c3(H+)?c3(OH-)]= Ksp[Fe(OH)3]/Kw3=2.63×10-39/(1.0×10-14) 3=2.63×103。
Fe3++3H2O,固体和纯液体不能写入平衡常数表达式,则该反应的平衡常数K=c(Fe3+)/c3(H+)=[c(Fe3+)?c3(OH-)]/[c3(H+)?c3(OH-)]= Ksp[Fe(OH)3]/Kw3=2.63×10-39/(1.0×10-14) 3=2.63×103。
练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目