ΧβΡΩΡΎ»ί
ΓΨΧβΡΩΓΩ“―÷Σœ¬Ν–»»Μ·―ßΖΫ≥Χ ΫΘΚ
ΔΌH2(g)+![]() O2(g)ΘΫH2O(l) ΠΛHΘΫ-285kJ/mol
O2(g)ΘΫH2O(l) ΠΛHΘΫ-285kJ/mol
ΔΎH2(g)+![]() O2(g)ΘΫH2O(g) ΠΛHΘΫ-241.8kJ/mol
O2(g)ΘΫH2O(g) ΠΛHΘΫ-241.8kJ/mol
ΔέC(s)+![]() O2(g)ΘΫCO(g) ΠΛHΘΫ-110.4 kJ/mol
O2(g)ΘΫCO(g) ΠΛHΘΫ-110.4 kJ/mol
ΔήC(s)+O2(g)ΘΫCO2(g) ΠΛHΘΫ-393.5 kJ/mol
ΜΊ¥πœ¬Ν–ΗςΈ ΘΚ
Θ®1Θ©…œ ωΖ¥”Π÷– τ”ΎΖ≈»»Ζ¥”ΠΒΡ «__ΓΘ
Θ®2Θ©CΒΡ»Φ…’»»ΈΣ___ΓΘ
Θ®3Θ©»Φ…’10gH2…ζ≥…“ΚΧ§Υ°Θ§Ζ≈≥ωΒΡ»»ΝΩΈΣ___ΓΘ
Θ®4Θ©CO»Φ…’ΒΡ»»Μ·―ßΖΫ≥Χ ΫΈΣ___ΓΘ
Θ®5Θ©ΈΣΝΥΩΊ÷ΤΈ¬ “–ß”ΠΘ§ΗςΙζΩΤ―ßΦ“Χα≥ωΝΥ≤Μ…Ό…ηœκΓΘ”–»ΥΗυΨί“ΚΧ§CO2ΟήΕ»¥σ”ΎΚΘΥ°ΟήΕ»ΒΡ ¬ ΒΘ§…ηœκΫΪCO2“ΚΜ·ΚσΘ§ΥΆ»κ…νΚΘΚΘΒΉΘ§“‘Φθ…Ό¥σΤχ÷–ΒΡCO2ΓΘΈΣ ΙCO2“ΚΜ·Θ§Ω…≤…»ΓΒΡ¥κ ©__ΓΘ
a.Φθ―ΙΓΔ…ΐΈ¬ b.‘ω―ΙΓΔΫΒΈ¬ c.Φθ―ΙΓΔΫΒΈ¬ d.‘ω―ΙΓΔ…ΐΈ¬
Θ®6Θ©–¥≥ωœ¬Ν–Ζ¥”ΠΒΡ»»Μ·―ßΖΫ≥Χ ΫΘ§N2(g)”κ ΝΩH2(g)Ζ¥”ΠΘ§…ζ≥…2molNH3(g)Θ§Ζ≈≥ω92.2kJ»»ΝΩ___ΓΘ
ΓΨ¥πΑΗΓΩΔΌΔΎΔέΔή 393.5kJ/mol 1425kJ CO(g)+![]() O2(g)ΘΫCO2(g) ΠΛHΘΫ-283.1kJ/mol b N2(g)ΘΪ3H2(g)=2NH3(g) ΠΛHΘΫΘ≠92.2kJΓΛmolΘ≠1
O2(g)ΘΫCO2(g) ΠΛHΘΫ-283.1kJ/mol b N2(g)ΘΪ3H2(g)=2NH3(g) ΠΛHΘΫΘ≠92.2kJΓΛmolΘ≠1
ΓΨΫβΈωΓΩ
Θ®1Θ©…œ ωΖ¥”Π÷– τ”ΎΖ≈»»Ζ¥”ΠΒΡ «ΠΛH<0ΒΡΖ¥”ΠΓΘ
Θ®2Θ©¥”ΓΑC(s)+O2(g)ΘΫCO2(g) ΠΛHΘΫ-393.5 kJ/molΓ±Ω…ΒΟ≥ωCΒΡ»Φ…’»»ΓΘ
Θ®3Θ©»Φ…’10gH2…ζ≥…“ΚΧ§Υ°Θ§Ζ≈≥ωΒΡ»»ΝΩΈΣ285kJ/molΓΝ5molΓΘ
Θ®4Θ©ΔέC(s)+![]() O2(g)ΘΫCO(g) ΠΛHΘΫ-110.4 kJ/mol
O2(g)ΘΫCO(g) ΠΛHΘΫ-110.4 kJ/mol
ΔήC(s)+O2(g)ΘΫCO2(g) ΠΛHΘΫ-393.5 kJ/mol
Δή-ΔέΩ…ΒΟ≥ωCO»Φ…’ΒΡ»»Μ·―ßΖΫ≥Χ ΫΓΘ
Θ®5Θ©ΈΣ ΙCO2“ΚΜ·Θ§Ω…≤…»ΓΒΡ¥κ ©‘ω―ΙΓΔΫΒΈ¬ΓΘ
Θ®6Θ©œ¬Ν–Ζ¥”ΠΒΡ»»Μ·―ßΖΫ≥Χ ΫΘ§N2(g)”κ ΝΩH2(g)Ζ¥”ΠΘ§…ζ≥…2molNH3(g)Θ§Ζ≈≥ω92.2kJ»»ΝΩΘ§‘ρ»»Μ·―ßΖΫ≥Χ ΫΈΣN2(g)+3H2(g) ![]() 2NH3(g) ΠΛHΘΫΘ≠92.2kJΓΛmolΘ≠1ΓΘ
2NH3(g) ΠΛHΘΫΘ≠92.2kJΓΛmolΘ≠1ΓΘ
Θ®1Θ©…œ ωΖ¥”Π÷– τ”ΎΖ≈»»Ζ¥”ΠΒΡ «ΔΌΔΎΔέΔήΓΘ¥πΑΗΈΣΘΚΔΌΔΎΔέΔήΘΜ
Θ®2Θ©¥”ΓΑC(s)+O2(g)ΘΫCO2(g) ΠΛHΘΫ-393.5 kJ/molΓ±Ω…ΒΟ≥ωCΒΡ»Φ…’»»ΈΣ393.5kJ/molΓΘ
Θ®3Θ©»Φ…’10gH2…ζ≥…“ΚΧ§Υ°Θ§Ζ≈≥ωΒΡ»»ΝΩΈΣ285kJ/molΓΝ5mol=1425kJΓΘ¥πΑΗΈΣΘΚ1425kJΘΜ
Θ®4Θ©ΔέC(s)+![]() O2(g)ΘΫCO(g) ΠΛHΘΫ-110.4 kJ/mol
O2(g)ΘΫCO(g) ΠΛHΘΫ-110.4 kJ/mol
ΔήC(s)+O2(g)ΘΫCO2(g) ΠΛHΘΫ-393.5 kJ/mol
Δή-ΔέΩ…ΒΟ≥ωCO»Φ…’ΒΡ»»Μ·―ßΖΫ≥Χ ΫCO(g)+![]() O2(g)ΘΫCO2(g) ΠΛHΘΫ-283.1kJ/molΓΘ¥πΑΗΈΣΘΚCO(g)+
O2(g)ΘΫCO2(g) ΠΛHΘΫ-283.1kJ/molΓΘ¥πΑΗΈΣΘΚCO(g)+![]() O2(g)ΘΫCO2(g) ΠΛHΘΫ-283.1kJ/molΘΜ
O2(g)ΘΫCO2(g) ΠΛHΘΫ-283.1kJ/molΘΜ
Θ®5Θ©ΈΣ ΙCO2“ΚΜ·Θ§Ω…≤…»ΓΒΡ¥κ ©‘ω―ΙΓΔΫΒΈ¬Θ§Φ¥―ΓbΓΘ¥πΑΗΈΣΘΚbΘΜ
Θ®6Θ©–¥≥ωœ¬Ν–Ζ¥”ΠΒΡ»»Μ·―ßΖΫ≥Χ ΫΘ§N2(g)”κ ΝΩH2(g)Ζ¥”ΠΘ§…ζ≥…2molNH3(g)Θ§Ζ≈≥ω92.2kJ»»ΝΩΘ§‘ρ»»Μ·―ßΖΫ≥Χ ΫΈΣN2(g)+3H2(g) ![]() 2NH3(g) ΠΛHΘΫΘ≠92.2kJΓΛmolΘ≠1ΓΘ¥πΑΗΈΣΘΚN2(g)+3H2(g)
2NH3(g) ΠΛHΘΫΘ≠92.2kJΓΛmolΘ≠1ΓΘ¥πΑΗΈΣΘΚN2(g)+3H2(g) ![]() 2NH3(g) ΠΛHΘΫΘ≠92.2kJΓΛmolΘ≠1ΓΘ
2NH3(g) ΠΛHΘΫΘ≠92.2kJΓΛmolΘ≠1ΓΘ

 ‘ΡΕΝΩλ≥ΒœΒΝ–¥πΑΗ
‘ΡΕΝΩλ≥ΒœΒΝ–¥πΑΗΓΨΧβΡΩΓΩ“―÷ΣΡ≥Μ·―ßΖ¥”ΠΒΡΤΫΚβ≥Θ ΐ±μ¥ο ΫΈΣ![]() Θ§‘Ύ≤ΜΆ§ΒΡΈ¬Ε»œ¬ΗΟΖ¥”ΠΒΡΤΫΚβ≥Θ ΐ»γ±μΥυ ΨΘΚ
Θ§‘Ύ≤ΜΆ§ΒΡΈ¬Ε»œ¬ΗΟΖ¥”ΠΒΡΤΫΚβ≥Θ ΐ»γ±μΥυ ΨΘΚ
t/ΓψC | 700 | 800 | 830 | 1000 | 1200 |
K | 1.67 | 1.11 | 1.00 | 0.60 | 0.38 |
œ¬Ν–”–ΙΊ–π ω≤Μ’ΐ»ΖΒΡ «
A.ΗΟΖ¥”ΠΒΡΜ·―ßΖΫ≥Χ Ϋ «COΘ®gΘ©+H2OΘ®gΘ©![]() CO2Θ®gΘ©+H2Θ®gΘ©
CO2Θ®gΘ©+H2Θ®gΘ©
B.…œ ωΖ¥”ΠΒΡ’ΐΖ¥”Π «Ζ≈»»Ζ¥”Π
C.»τΤΫΚβ≈®Ε»ΖϊΚœœ¬Ν–ΙΊœΒ ΫΘΚ![]() Θ§‘ρ¥Υ ±ΒΡΈ¬Ε»ΈΣ1 000 ΓψC
Θ§‘ρ¥Υ ±ΒΡΈ¬Ε»ΈΣ1 000 ΓψC
D.‘Ύ1LΒΡΟή±’»ίΤς÷–Ά®»κCO2ΚΆH2Ης1molΘ§5 minΚσΈ¬Ε»…ΐΗΏΒΫ830ΓψCΘ§¥Υ ±≤βΒΟCOΈΣ0.4 molΘ§‘ρΗΟΖ¥”Π¥οΒΫΤΫΚβΉ¥Χ§
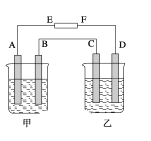
ΓΨΧβΡΩΓΩΡ≥ Β―ι–ΓΉιΧΫΨΩ≤ΙΧζΩΎΖΰ“Κ÷–Χζ‘ΣΥΊΒΡΦέΧ§Θ§≤Δ≤βΕ®ΗΟ≤ΙΧζΩΎΖΰ“Κ÷–Χζ‘ΣΥΊΒΡΚ§ΝΩ «Ζώ¥ο±ξΓΘ
![]()
(1) Β―ι“ΜΘΚΧΫΨΩ≤ΙΧζΩΎΖΰ“Κ÷–Χζ‘ΣΥΊΒΡΦέΧ§ΓΘ
ΦΉΆ§―ßΘΚ»Γ1 mL≤ΙΧζΩΎΖΰ“ΚΘ§Φ”»κK3[Fe(CN)6]Θ®Χζ«ηΜ·ΦΊΘ©»ή“ΚΘ§…ζ≥…άΕ…Ϊ≥ΝΒμΘ§÷ΛΟςΗΟ≤ΙΧζΩΎΖΰ“Κ÷–Χζ‘ΣΥΊ“‘Fe2+–Έ Ϋ¥φ‘ΎΓΘ
““Ά§―ßΘΚ»Γ5 mL≤ΙΧζΩΎΖΰ“ΚΘ§ΒΈ»κ10ΒΈKSCN»ή“ΚΈόœ÷œσΘ§‘ΌΒΈ»κ10ΒΈΥΪ―θΥ°Θ§Έ¥ΦϊΒΫΚλ…ΪΓΘ““Ά§―ßΈΣΖ÷ΈωΟΜ”–≥ωœ÷Κλ…Ϊ Β―ιœ÷œσΒΡ‘≠“ρΘ§ΫΪ…œ ω»ή“ΚΤΫΨυΖ÷ΈΣ3ΖίΫχ––ΧΫΨΩΘΚ
‘≠“ρ | Β―ι≤ΌΉςΦΑœ÷œσ | Ϋα¬έ | ||
1 | ΤδΥϊ‘≠Νœ”Αœλ | ““Ά§―ßΙέ≤λΗΟ≤ΙΧζΩΎΖΰ“ΚΒΡ≈δΝœ±μΘ§ΖΔœ÷Τδ÷–”–Έ§…ζΥΊCΘ§Έ§…ζΥΊC”–ΜΙ‘≠–‘Θ§ΤδΉς”Ο «ΔΌ______ | »ΓΒΎ1Ζί»ή“ΚΘ§ΦΧ–χΒΈ»κΉψΝΩΒΡΥΪ―θΥ°Θ§»‘Έ¥ΦϊΚλ…Ϊ≥ωœ÷ | ≈≈≥ΐΔΎ_________”Αœλ |
2 | ΝΩΒΡ‘≠“ρ | ΥυΦ”Δέ________»ή“ΚΘ®–¥Μ·―ß ΫΘ©ΧΪ…ΌΘ§Εΰ’ΏΟΜ”–¥οΒΫΖ¥”Π≈®Ε» | »ΓΒΎ2Ζί»ή“ΚΘ§ΦΧ–χΒΈΦ”ΗΟ»ή“Κ÷ΝΉψΝΩΘ§»‘»ΜΈ¥≥ωœ÷Κλ…Ϊ | ΥΒΟς≤Μ «ΗΟ»ή“ΚΝΩ…ΌΒΡ”Αœλ |
3 | ¥φ‘Ύ–Έ Ϋ | ΧζΒΡΦέΧ§ «+3ΦέΘ§ΒΪΩ…Ρή≤Μ «“‘Ή‘”…άκΉ”Fe3+–Έ Ϋ¥φ‘Ύ | »ΓΒΎ3Ζί»ή“ΚΘ§ΒΈΦ”1ΒΈœΓΝρΥαΘ§»ή“Κ―ΗΥΌ±δΈΣΚλ…Ϊ | ΥΒΟςFe3+“‘Δή_______–Έ Ϋ¥φ‘ΎΘ§”ΟΜ·―ßΖΫ≥Χ ΫΫαΚœΈΡΉ÷Θ§ΥΒΟςΦ”ΥαΚσ―ΗΥΌœ‘Κλ…ΪΒΡ‘≠“ρ |
(2)ΦΉΆ§―ßΉΔ“βΒΫ““Ά§―ßΦ”œΓΝρΥα±δΚλΚσΒΡ»ή“ΚΘ§Ζ≈÷Ο“ΜΕΈ ±ΦδΚσ―’…Ϊ”÷±δ«≥ΝΥΘ§ΥϊΖ÷ΈωΝΥSCN-÷–Ης‘ΣΥΊΒΡΜ·ΚœΦέΘ§»ΜΚσΫΪ±δ«≥ΚσΒΡ»ή“ΚΖ÷ΈΣΝΫΒ»ΖίΘΚ“ΜΖί÷–ΒΈ»ΥKSCN»ή“ΚΘ§ΖΔœ÷Κλ…Ϊ”÷±δ…νΘΜΝμ“ΜΖίΒΈ»κΥΪ―θΥ°Θ§ΖΔœ÷Κλ…Ϊ±δΒΟΗϋ«≥Θ§ΒΪΈό≥ΝΒμΘ§“≤Έό¥ΧΦΛ–‘ΤχΈΕΒΡΤχΧε…ζ≥…ΓΘΗυΨί Β―ιœ÷œσΘ§”ΟάκΉ”ΖΫ≥Χ Ϋ±μ ΨΖ≈÷ΟΚσ»ή“Κ―’…Ϊ±δ«≥ΒΡ‘≠“ρ________ΓΘ
(3) Β―ιΕΰΘΚ≤βΝΩ≤ΙΧζΩΎΖΰ“Κ÷–Χζ‘ΣΥΊΒΡΚ§ΝΩ «Ζώ¥ο±ξΓΘ
ΗΟ≤ΙΧζΩΎΖΰ“Κ±ξ«©ΉΔΟςΘΚ±ΨΤΖΚ§ΝρΥα―«Χζ(FeSO4ΓΛ7H2O)”ΠΈΣ375ΓΪ425(mg/100 mL)Θ§ΗΟ Β―ι–ΓΉι…ηΦΤ»γœ¬ Β―ιΘ§≤βΕ®Τδ÷–Χζ‘ΣΥΊΒΡΚ§ΝΩΓΘΘ®ΥΒΟςΘΚΗΟ Β―ι÷–Έ§…ζΥΊCΒΡ”Αœλ“―≈≈≥ΐΘ§≤Μ–η“ΣΩΦ¬«Έ§…ζΥΊCœϊΚΡΒΡΥα–‘KMnO4»ή“ΚΘ©
ΔΌ»ΓΗΟ≤ΙΧζΩΎΖΰ“Κ100 mLΘ§Ζ÷≥…ΥΡΒ»ΖίΘ§Ζ÷±πΖ≈»κΉΕ–ΈΤΩ÷–Θ§≤ΔΖ÷±πΦ”»κ…ΌΝΩœΓΝρΥα’ώΒ¥ΘΜ
ΔΎœρ ________ ΫΒΈΕ®Ιή÷–Φ”»κ0.002 mol.L-lΥα–‘KMnO4»ή“ΚΘ§≤ΔΦ«¬Φ≥θ ΦΧεΜΐΘΜ
ΔέΒΈΕ®Θ§÷±÷Ν»ή“Κ«ΓΚΟ_____________«“30ΟκΡΎ≤ΜΆ …ΪΘ§Φ«¬ΦΡ©ΧεΜΐΘΜ
Δή÷ΊΗ¥ Β―ιΓΘΗυΨί ΐΨίΦΤΥψΘ§ΤΫΨυœϊΚΡΥα–‘KMnO4»ή“ΚΒΡΧεΜΐΈΣ35.00 mLΓΘΦΤΥψΟΩ100 mLΗΟ≤ΙΧζΩΎΖΰ“Κ÷–Κ§Χζ‘ΣΥΊ__________mgΘ®“‘FeSO4ΓΛ7H2OΒΡ÷ ΝΩΦΤΥψΘ©Θ§≈–ΕœΗΟ≤ΙΧζΩΎΖΰ“Κ÷–Χζ‘ΣΥΊΚ§ΝΩ___________Θ®ΧνΓΑΚœΗώΓ±ΜρΓΑ≤ΜΚœΗώΓ±Θ©ΓΘ