题目内容
下图各容器中盛有海水,铁在其中腐蚀时由快到慢的顺序是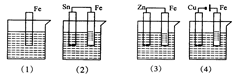
| A.⑷>⑵>⑶>⑴ | B.⑵>⑴>⑶>⑷ | C.⑷>⑵>⑴>⑶ | D.⑶>⑵>⑷>⑴ |
C
解析试题分析:金属在同一电解质溶液中:电解引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防腐措施的腐蚀。因此⑷中Fe做电解池的阳极,腐蚀最快;⑵中Sn、Fe构成原电池,Fe比Sn更活泼,铁做负极被氧化腐蚀;⑴中Fe仅发生化学腐蚀;⑶中Zn、Fe构成原电池,Zn比Fe更活泼,Fe做正极被保护,所以本题应选C。
考点:本题考查的是金属的腐蚀与原电池、电解池的关系。

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
如图是一种可充电的锂离子电池充放电的工作示意图。放电时该电池的电极反应式为:负极:LixC6-xe-=C6+xLi+(LixC6表示锂原子嵌入石墨形成的复合材料)正极:Li1-xMnO2+xLi++xe-=LiMnO2(LiMnO2表示含锂原子的二氧化锰)。下列有关说法正确的是 ( )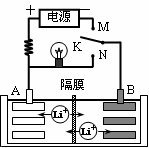
| A.在整个充、放电过程中至少存在3种形式的能量转化 |
| B.K与M相接时,A是阴极,发生还原反应 |
| C.K与N相接时,Li+由A极区迁移到B极区 |
D.该电池的总反应式为Li1-xMnO2+LixC6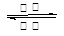 LiMnO2+C6 LiMnO2+C6 |
如图所示,将铁棒和石墨棒插入1L 1mol﹒L-1食盐水中。下列说法正确的是( )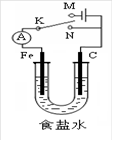
| A.若电键K与N连接,铁被保护不会腐蚀 |
| B.若电键K与N连接,正极反应式是4OH- -4e-=2H2O+O2↑ |
| C.若电键K与M连接,将石墨棒换成铜棒可实现铁棒上镀铜 |
| D.若电键K与M连接,当两极共产生28 L(标准状况)气体时,生成1 mol NaOH |
X、Y、Z、M代表四种金属元素。金属X和Z用导线连接放入稀硫酸中时,X溶解,Z极上有氢气放出;若电解Y2+和Z2+离子共存的溶液时,Y先析出;又知M2+离子的氧化性强于Y2+离子。则这四种金属的活动性由强到弱的顺序为
| A.M>Z>X>Y | B.X>Y>Z>M | C.X>Z>Y>M | D.X>Z>M>Y |
如图所示为某原电池的结构示意图,下列说法不正确的是(盐桥中装满用饱和KCl溶液和琼胶做成的冻胶) ( )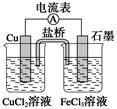
| A.该原电池的总反应式为2Fe3++Cu=2Fe2++Cu2+ |
| B.该电池工作时,Cu2+在电极上得到电子,发生还原反应 |
| C.该电池工作时,氯化铜溶液中氯离子浓度增大 |
| D.电池工作过程中,电子由铜电极经过电流表流向石墨电极 |
下列关于化学能与电能相互转化的说法正确的是
| A.在原电池中,化学能转变为电能,电子沿导线由正极流向负极 |
| B.双液原电池通过盐桥连接,KCl盐桥中K+朝正极定向迁移 |
| C.在电解池中,与电源负极相连的电极称为阳极,溶液中阴离子朝阳极定向迁移 |
| D.电解氯化铜溶液,在阴极上产生的气体能使湿润的KI-淀粉试纸变蓝 |
下列有关金属的说法正确的是( )
| A.牺牲阳极的阴极保护法构成原电池,被保护的金属作正极 |
| B.当镀锌铁制品的镀层破损时,镀层不能对铁制品起保护作用 |
| C.不锈钢不易生锈是因为表面有保护膜 |
| D.可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀 |
家用炒菜铁锅用水清洗放置后,出现红棕色的锈斑,在此变化过程中不发生的化学反应是
| A.4Fe(OH)2+2H2O+O2=4Fe(OH)3↓ |
| B.2Fe+2H2O+O2=2Fe(OH)2↓ |
| C.2H2O+O2+4e-=4OH- |
| D.Fe-3e-=Fe3+ |
将等物质的量浓度的CuSO4溶液和NaCl溶液等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如图,则下列说法正确的是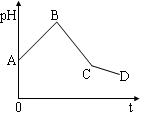
| A.阳极产物一定是Cl2,阴极产物一定是Cu |
| B.BC段表示在阴极上是H+放电产生了H2 |
| C.整个过程中阳极先产生Cl2,后产生O2 |
| D.CD段表示阳极上OH一放电破坏了水的电离平衡,产生了H+ |