题目内容
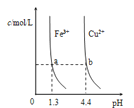
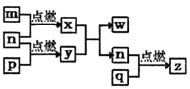
【题目】短周期主族元素,a、b、c、d的原子序数依次增大。四种元素形成的单质依次为m、n、p、q;x、y、z是这些元素组成的二元化合物,其中z为形成酸雨的主要物质之一;25℃0.01mol·L-1w溶液中,![]() 。上述物质的转化关系如图所示。下列说法正确的是
。上述物质的转化关系如图所示。下列说法正确的是
A. 原子半径的大小:a<b<c<d B. 氢化物的沸点:b>d
C. x的电子式为:![]() D. y、w含有的化学键类型完全相同
D. y、w含有的化学键类型完全相同
【答案】B
【解析】z是形成酸雨的主要物质之一,推出z是SO2,n、p为单质,因此n、p为S和O2, c(H+)/c(OH-)=10-10,溶液显碱性,即c(OH-)=10-2mol·L-1,w为强碱,即NaOH, 推出x和y反应可能是Na2O2与H2O反应,即n为O2,q为S,四种元素原子序数增大,推出a为H,b为O,p为Na,A、半径大小比较:一看电子层数,电子层数越多,半径越大,二看原子序数,电子层数相同,半径随着原子序数增大而减小,因此半径顺序是:Na>S>O>H,故错误;B、氢化物分别是H2O、H2S,H2O中含有分子间氢键,H2S没有,则H2O的沸点高于H2S,故正确;C、x为H2O,其电子式为:![]() ,故错误;D、y是过氧化钠,w为NaOH,前者只含离子键,后者含有离子键和共价键,故错误。
,故错误;D、y是过氧化钠,w为NaOH,前者只含离子键,后者含有离子键和共价键,故错误。

【题目】下列实验操作规范并能达到实验目的是
选项 | 实验操作 | 实验目的 |
A | 在一定条件下,向混有少量乙烯的乙烷中通入氢气 | 除去乙烷中的乙烯 |
B | 用玻璃棒蘸取待测液,点在干燥的pH试纸中部,片刻后与标准比色卡比较并读数 | 粗略测定NaClO溶液的pH |
C | 将0.1mol/LMgSO4溶液滴入到2mLNaOH溶液中至不再有沉淀生成,再滴入0.1mol/LCuSO4溶液 | 比较Mg(OH)2和Cu(OH)2的Ksp大小 |
D | 向亚硫酸钠溶液中滴加硝酸钡和稀硝酸 | 检验亚硫酸钠溶液是否变质 |
A.AB.BC.CD.D
【题目】在2L的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
t℃ | 600 | 800 | 830 | 1000 | 1200 |
K | 0.25 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K = 。
(2)该反应为 反应(选填“吸热”、“放热”)。反应达平衡后,若再通入一定量CO2,则平衡常数K将________,CO2的转化率________。(填“增大”、“减小”或“不变”)
(3)能判断该反应是否达到化学平衡状态的依据是 (多选扣分)。
a.容器中压强不变 b.混合气体中c(CO)不变 c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)若 600℃时,向容器中充入1mol CO、1mol H2O,反应达到平衡后,CO的转化率是 。