题目内容
【题目】在下列粒子半径的比较中,正确的是
A. Na+ >Na B. Cl->Cl C. Ca2+ >Cl- D. Mg>Na
【答案】B
【解析】试题分析:阳离子的半径比其原子半径小,阴离子半径比其原子半径大,所以A错,B对;Ca2+和Cl-均具有与Ar原子相同的电子层结构,因为Ca2+的核电荷数大,故半径Ca2+<Cl-,C错误;Mg和Na的原子核外电子层数相同,Mg的核电荷数大于Na,则Mg的原子半径小于Na的原子半径,D错误,答案选B。

练习册系列答案
相关题目
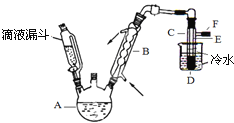
【题目】下图是实验室用乙醇、硫酸、溴化钠混合反应来制备溴乙烷的装置。反应需要加热,图中省去了加热装置。乙醇、溴乙烷、溴的有关性状参数见下表。
乙醇 | 溴乙烷 | 溴 | |
状态 | 无色液体 | 无色液体 | 深红棕色液体 |
密度/g.cm-3 | 0.79 | 1.44 | 3.1 |
沸点/℃ | 78.5 | 38.4 | 59 |
水溶性 | 易溶 | 难溶 | 微溶 |
(1)加热A中三种反应物的混合物时,发生反应的化学方程式为: 。
(2)若选用较浓的硫酸作为反应物,得到的产品则会呈棕黄色,这说明反应过程中有 生成。为去除颜色,最好选择下列的 溶液来洗涤产品。
A.四氯化碳 B.硫酸钠 C.碘化亚铁 D.亚硫酸钠
产品选择上述溶液洗涤后,还需再用蒸馏水洗涤一次。洗涤液与产品分离的方法是 (填方法名称)。
(3)装置中,B和D两部分的作用分别是:B ;D 。