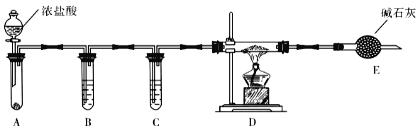
题目内容
【题目】A、B、C、D、E都是短周期元素,原子序数依次增大,A、B处于同一周期,C、D、E同处另一周期。C、B可按原子个数比2∶1和1∶1分别形成两种化合物甲和乙。D、A按原子个数比3∶2形成化合物丙。E是地壳中含量最高的金属元素。根据以上信息回答下列问题:
(1)B元素在周期表中的位置是_________________。
(2)A单质的电子式_________________。
(3)D的简单阳离子的离子结构示意图_________________。
(4)A、B、C、D、E五种元素的原子半径由大到小的顺序是(用元素符号填写)_________。
(5)用电子式表示C2B2的形成过程___________________________________。
(6)写出E的单质与C元素的最高价氧化物对应的水化物反应的离子方程式:____;
【答案】第二周期ⅥA族 ![]()
![]() Na>Mg>Al>N>O
Na>Mg>Al>N>O ![]() 2Al+2OH-+6H2O=2[Al(OH)4 ]- +3H2↑(或2Al+2OH-+2H2O═2AlO2-+3H2↑)
2Al+2OH-+6H2O=2[Al(OH)4 ]- +3H2↑(或2Al+2OH-+2H2O═2AlO2-+3H2↑)
【解析】
A、B、C、D、E都是短周期元素,原子序数依次增大,A、B处于同一周期,C、D、E同处另一周期,则A、B处于第二周期,C、D、E处于第三周期;C、B可按原子个数比2∶1和1∶1分别形成两种化合物甲和乙,则C为Na元素,B为O元素;E是地壳中含量最高的金属元素,则E为Al元素;D、A按原子个数比3∶2形成化合物丙,则D为Mg元素、A为N元素,据此分析解答。
根据上述分析,A为N元素,B为O元素,C为Na元素,D为Mg元素,E为Al元素。
(1)B为O元素,在周期表中位于第二周期ⅥA族,故答案为:第二周期ⅥA族;
(2)A为氮元素,A单质的电子式为![]() ,故答案为:
,故答案为:![]() ;
;
(3) D为镁元素,简单阳离子的离子结构示意为![]() ,图故答案为:
,图故答案为:![]() ;
;
(4)同一周期自左而右,原子半径逐渐减小,同一主族自上而下,原子半径逐渐增大,故原子半径:Na>Mg>Al>N>O,故答案为:Na>Mg>Al>N>O;
(5)C2B2为Na2O2,是由2个钠离子和1个过氧根离子构成,过氧化钠的形成过程用电子式表示为![]() ,故答案为:
,故答案为:![]() ;
;
(6)E的单质为Al,C的最高价氧化物的水化物为NaOH,它们反应的离子方程式为2Al+2OH-+2H2O═2AlO2-+3H2↑(或2Al+2OH-+6H2O=2[Al(OH)4 ]- +3H2↑),故答案为:2Al+2OH-+2H2O═2AlO2-+3H2↑(或2Al+2OH-+6H2O=2[Al(OH)4 ]- +3H2↑)。

 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案【题目】近年来“雾霾”污染日益严重,原因之一是机动车尾气中含有NO、NO2、CO等气体,火力发电厂释放出大量的NOx、SO2和CO2等气体也是其原因,现在对其中的一些气体进行了一定的研究:
(1)用 CH4催化还原氮氧化物可以消除氮氧化物的污染。
已知:①CH4(g) + 4NO2(g) = 4NO(g) + CO2(g) + 2H2O(g) △H = - 574 kJ/mol
②CH4(g) + 4NO(g) = 2N2(g) + CO2(g) + 2H2O(g) △H = - 1160 kJ/mol
③H2O(g) = H2O(l) △H = - 44.0 kJ/mol
写出 CH4(g)与 NO2(g)反应生成 N2(g)、CO2(g)和 H2O(l)的热化学方程式:____________。
(2)汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体转化为无毒气体。4CO(g)+2NO2(g) ![]() 4CO2(g)+N2(g) ΔH=-1200 kJ·mol-1,对于该反应,温度不同(T2>T1)、其他条件相同时,下列图像正确的是________(填代号)。
4CO2(g)+N2(g) ΔH=-1200 kJ·mol-1,对于该反应,温度不同(T2>T1)、其他条件相同时,下列图像正确的是________(填代号)。

(3)用活性炭还原法也可以处理氮氧化物,某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s)+2NO(g) ![]() N2(g)+CO2(g) ΔH= a kJ/mol
N2(g)+CO2(g) ΔH= a kJ/mol
在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
时间/min 浓度/(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.0 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
根据图表数据分析T1℃时,该反应在0-20min的平均反应速率
①v(NO)= _________ ;计算该反应的平衡常数K=___________________。
②30min后,只改变某一条件,根据上表的数据判断改变的条件可能是 ____________(填字母代号)。(双选)
A.通入一定量的CO2 B.加入合适的催化剂 C.适当缩小容器的体积
D.通入一定量的NO E.加入一定量的活性炭
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为2:1:1,则达到新平衡时NO的转化率_______(填“升高”或“降低”),a _____0(填“>”或“<”)。