题目内容
已知短周期元素R、W、X、Y、Z的原子序数依次增大,其氢化物中上述元素的化合价如下表,下列说法正确的是( )
| 元素 | R | W | X | Y | Z |
| 化合价 | -4 | +1 | -4 | -2 | -1 |
| A、离子还原性:Y2->Z- |
| B、离子半径W+>Z- |
| C、气态氢化物稳定性:RH4<XH4 |
| D、酸性:H2YO4<HZO4 |
考点:原子结构与元素周期律的关系
专题:元素周期律与元素周期表专题
分析:短周期元素R、W、X、Y、Z的原子序数依次增大,R、X氢化物中化合价都为-4价,应为第ⅣA族元素,且原子序数R<X,则R为C元素,X为Si元素,W氢化物中化合价都为+1价,处于ⅠA族,原子序数大于碳,故W为Na;Y氢化物中化合价都为-2价,Z的氢化物中化合价都为-1价,结合原子序数可知Y为S,则Z为Cl,据此解答.
解答:
解:短周期元素R、W、X、Y、Z的原子序数依次增大,R、X氢化物中化合价都为-4价,应为第ⅣA族元素,且原子序数R<X,则R为C元素,X为Si元素,W氢化物中化合价都为+1价,处于ⅠA族,原子序数大于碳,故W为Na;Y氢化物中化合价都为-2价,Z的氢化物中化合价都为-1价,结合原子序数可知Y为S,则Z为Cl,
A.Y为S,则Z为Cl,非金属性S<Cl,故离子还原性:S2->Cl-,故A正确;
B.W为Na,Z为Cl,Na+离子比Cl-离子少一个电子层,故离子半径:Na+<Cl-,故B错误;
C.R为C元素,X为Si元素,非金属性C>Si,故氢化物稳定性CH4>SiH4,故C错误;
D.Y为S,则Z为Cl,非金属性S<Cl,酸性:H2SO4<HClO4,故D正确,
故选AD.
A.Y为S,则Z为Cl,非金属性S<Cl,故离子还原性:S2->Cl-,故A正确;
B.W为Na,Z为Cl,Na+离子比Cl-离子少一个电子层,故离子半径:Na+<Cl-,故B错误;
C.R为C元素,X为Si元素,非金属性C>Si,故氢化物稳定性CH4>SiH4,故C错误;
D.Y为S,则Z为Cl,非金属性S<Cl,酸性:H2SO4<HClO4,故D正确,
故选AD.
点评:本题考查结构性质位置关系应用,侧重于学生的分析能力的考查,从化合价的角度判断元素的种类是解题的关键,注意掌握微粒半径比较与元素周期律,难度中等.

练习册系列答案
 一线名师权威作业本系列答案
一线名师权威作业本系列答案
相关题目
下列变化过程中,需要加入还原剂的是( )
| A、HCl→H2 |
| B、FeCl2→FeCl3 |
| C、Na2SO3→SO2 |
| D、Fe→Fe3O4 |
下列离子方程式正确的是( )
| A、Al与NaOH溶液反应:2Al+2OH-+2H2O=2AlO2-+3H2↑ |
| B、FeBr2溶液中通入少量Cl2:2Fe2++2Br-+Cl2=2Fe3++Br2+2Cl- |
| C、稀硝酸除银镜:Ag+2H++NO3-=Ag++NO2↑+H2O |
| D、烧碱溶液中通入过量SO2:2OH-+SO2=SO32-+H2O |
化学与生活是紧密相联的,下列说法正确的是( )
| A、为防止中秋月饼等富脂食品氧化变质,常在包装袋中放入生石灰 |
| B、发酵粉能使烘焙出的糕点疏松多孔,是因为发酵粉中含有碳酸钠 |
| C、针对甲型H1N1流感的扩散情况,要加强环境、个人等的消毒预防,其中消毒剂常选用含氯消毒剂、双氧水、酒精等适宜的物质 |
| D、加碘食盐中添加碘酸钾而不是碘化钾,是因为碘酸钾能溶于水而碘化钾不溶于水 |
下列离子方程式书写正确的是( )
| A、碳酸钙和盐酸反应:CO32-+2H+=CO2↑+H2O |
| B、向NaOH溶液中滴加少量Ca(HCO3)2溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O |
| C、铜粉与氯化铁溶液反应:Cu+Fe3+=Fe2++Cu2+ |
| D、向Ba(OH)2溶液与H2SO4反应:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O |
下列物质可以发生加成反应的是( )
| A、乙烷 | B、环丙烷 |
| C、乙烯 | D、聚乙烯 |
有机物的命名是有规则的,下列有机物命名正确的是( )
| A、CH2=CH-CH=CH2 1,3-二丁烯 |
B、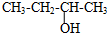 三丁醇 三丁醇 |
C、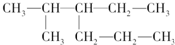 2甲基3丙基戊烷 2甲基3丙基戊烷 |
D、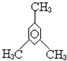 1,3,5-三甲基苯 1,3,5-三甲基苯 |
下列反应中,属于加成反应的是( )
| A、乙烯通入酸性KMnO4溶液 |
| B、乙烷与溴蒸气反应 |
| C、乙烯在一定条件下与水反应生成乙醇 |
| D、乙烯燃烧生成二氧化碳和水 |