题目内容
连二亚硫酸钠(Na2S2O4)俗称保险粉,是一种强还原剂,工业上可通过吸收大气污染物(含有SO2、NO等制取),同时还可得到NH4NO3产品,工艺流程图如下(Ce为铈元素):

请回答下列问题:
(1)装置I中可生成NaHSO3。常温下NaHSO3溶液呈酸性的原因是____________。
(2)装置II中酸性条件下,NO被Ce4+氧化为NO3- 时,氧化产物与还原产物的物质的量之比为______。
(3)装置III中阴极上的电极反应式为__________。若装置IV中NO2- 的浓度为11.5g·L-1要使1dm3该
溶液中的NO2- 完全转化为NH4NO3,至少向装置IV中通入标准状况下的O2__________L。
(4)Na2S2O4在空气中容易被氧化,其反应方程式可能为:
①2Na2S2O4+O2+2H2O=4NaHSO3;
②Na2S2O4+O2+H2O=NaHSO3+ NaHSO4。
请设计实验证明氧化时一定有反应②发生______________。
(5)SO2—空气质子交换膜燃料电池原理示意图如下图:

质子的流动方向为__________(“从A到B”或“从B到A”),负极的电极反应式为_____________。
 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案金属钒及其化合物有着广泛的应用,现有如下回收利用含钒催化剂[含有V2O5、VOSO4(强电解质)及不溶性残渣]的工艺的主要流程:
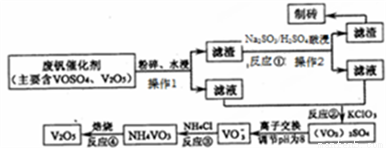
部分含钒物质在水中的溶解性如下表所示:
物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 | HVO3 |
溶解性 | 可溶 | 难溶 | 难溶 | 易溶 | 难溶 |
请回答下列问题:
(1)工业上常用铝热反应由V2O5冶炼金属钒,化学方程式为__________。
(2)反应①、②、③、④中,发生氧化还原反应的是__________(填序号),写出反应①的离子方程式____。操作1、操作2用到的玻璃仪器是___________。
(3)反应③的沉淀率(又称沉钒率)是回收钒的关键之一,下图是反应温度与沉钒率的关系图,则控制温度的方法是_____________。
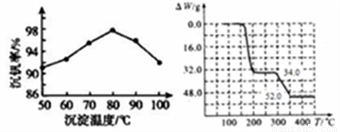
(4)反应④在焙烧过程中随温度的升高发生了两步反应。已知234gNH4VO3固体质量的减少值△W随温度(T)变化的曲线如图。试写出300℃~350℃时反应的化学方程式___________。
(5)全钒电池的电解质溶液为VOSO4溶液,电池的工作原理为VO2++V2++2H+ VO2++H2O+V3+。电池充电时阳极的电极反应式为____________。
VO2++H2O+V3+。电池充电时阳极的电极反应式为____________。
下列离子组在一定条件下能大量共存,且加入相应试剂后所对应的离子方程式正确的是
选项 | 离子组 | 加入试剂 | 加入试剂后发生反应的离子方程式 |
A | Fe2+、NO3-、K+ | 稀硫酸 | 3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O |
B | Fe3+、I-、ClO- | 氢氧化钠溶液 | Fe3++3OH-=Fe(OH)3↓ |
C | Ba2+、HCO3-、Cl- | 氢氧化钠溶液 | HCO3-+ OH-=CO32-+H2O |
D | Al3+、Cl-、NO3- | 过量氢氧化钠液 | Al3++3OH-=Al(OH)3↓ |
A. A B. B C. C D. D
下列除去杂质(括号内的物质是杂质)时,选用的试剂或方法正确的是( )
A | B | C | D | |
试样 | NaCl溶液(Na2CO3) | NH4Cl固体(I2) | CO2(SO2) | NaBr溶液(Br2) |
除杂试剂 或方法 | 澄清石灰水 | 加热 | NaOH溶液 | 用CCl4萃取、 分液 |
A. A B. B C. C D. D

 CH4+2H2O。该反应的下列说法正确的是( )
CH4+2H2O。该反应的下列说法正确的是( )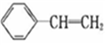 。有关该物质的下列说法正确的是
。有关该物质的下列说法正确的是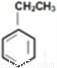 中的苯乙烯可以通入等量氢气反应
中的苯乙烯可以通入等量氢气反应


 时,c(C2O42-)>c(HC2O4-)>c(H2C2O4)>c(OH-)
时,c(C2O42-)>c(HC2O4-)>c(H2C2O4)>c(OH-)