题目内容
【题目】有以下几种物质①熔融氯化钠 ②浓硫酸 ③Cu ④蔗糖 ⑤CH3COOH ⑥酒精 ⑦液溴,填空回答:(填序号)
(1)以上物质中属于强电解质的是 ;属于非电解质的是 ;
(2)写出⑤在水中的电离方程式: ;
(3)写出②与③共热时的化学反应方程式: 。
【答案】(1)①;④⑥(2)CH3COOH![]() CH3COO-+H+
CH3COO-+H+
(3)Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
【解析】
试题分析:(1)水溶液中或熔融状态下能够导电的化合物称为电解质,酸、碱、盐都是电解质;在上述两种情况下都不能导电的化合物称为非电解质,蔗糖、乙醇等都是非电解质.大多数的有机物都是非电解质;单质,混合物不管在水溶液中或熔融状态下能够导电与否,都不是电解质或非电解质,溶于水能全部电离的电解质是强电解质,因此以上物质中属于强电解质的是①;属于非电解质的是④⑥。
(2)醋酸的弱酸,在水中部分电离,电离方程式为CH3COOH![]() CH3COO-+H+。
CH3COO-+H+。
(3)铜与浓硫酸反应生成硫酸铜、SO2和水,反应的化学方程式为Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O。
CuSO4+SO2↑+2H2O。

 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案【题目】利用如图装置制取ClO2 , 并以ClO2为原料制备亚氯酸钠(NaClO2是一种高效氧化剂、漂白剂).已知:NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO23H2O,高于38℃时析出晶体是NaClO2 , 高于60℃时NaClO2分解成NaClO3和NaCl. 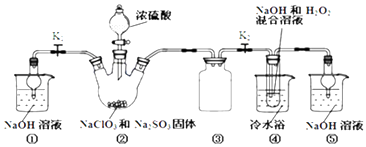
完成下列填空:
(1)装置②中产生ClO2的化学方程式为;装置④中发生反应的离子方程式为 .
(2)装置③的作用是;装置①和⑤在本实验中的作用 .
(3)装置④反应后的溶液中还含有少量NaOH杂质,从该溶液获得无水NaClO2晶体的操作步骤为:①减压,55℃左右蒸发结晶;②趁热过滤;③用50℃左右的温水洗涤;④低于60℃干燥,得到成品.步骤③中用50℃左右的温水洗涤的原因是 .
(4)亚氯酸钠纯度测定:①准确称取所得亚氯酸钠样品10.0g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应.将所得混合液配成250mL待测溶液.②取25.00mL待测液,用2.0 molL﹣1Na2S2O3标准液滴定(I2+2S2O32﹣=2I﹣+S4O62﹣),以淀粉溶液做指示剂,达到滴定终点时的现象为 . 重复滴定3次,测得数据如表所示,则该样品中NaClO2的质量分数为 .
实验序号 | 滴定前读数/mL | 滴定后读数/mL |
1 | 0.00 | 19.96 |
2 | 3.26 | 23.30 |
3 | 1.10 | 23.40 |
(5)实验过程中若NaClO2变质可分解为NaClO3和NaCl.取等质量NaClO2 , 其中一份加热高于60℃使之变质,另一份严格保存,均配成溶液,并分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量(填“相同”“不相同”或“无法判断”).