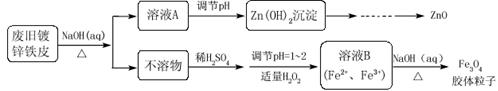
题目内容
工业上以锂辉石(Li2O·Al2O3·4SiO2,含少量Ca、Mg元素)为原料生产碳酸锂。其部分工艺流程如下:
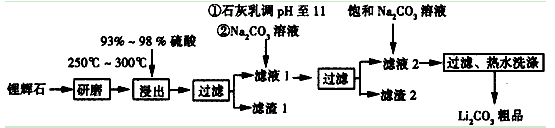
已知:①Li2O·Al2O3·4SiO2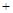 H2SO4(浓)
H2SO4(浓) Li2SO4
Li2SO4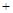 Al2O3·4SiO2·H2O↓
Al2O3·4SiO2·H2O↓
②某些物质的溶解度(S)如下表所示:
③从滤渣1中提取出Si的部分流程如下图所示:

根据以上信息,请回答下列问题:
(1)括号内应提供的相应条件和物质 、 。
(2)方框中所得物质的化学式 。
(3)使用浓硫酸并加热到250℃~300℃的目的是 。
(4)②处加Na2CO3溶液所发生反应的离子方程式 、 。
(5)滤渣2的主要成分有 。
(6)如何检验Li2CO3是否洗涤干净? 。

已知:①Li2O·Al2O3·4SiO2
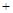 H2SO4(浓)
H2SO4(浓) Li2SO4
Li2SO4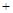 Al2O3·4SiO2·H2O↓
Al2O3·4SiO2·H2O↓②某些物质的溶解度(S)如下表所示:
| T/℃ | 20 | 40 | 60 | 80 |
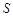 (Li2CO3)/g (Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
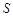 (Li2SO4)/g (Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
③从滤渣1中提取出Si的部分流程如下图所示:

根据以上信息,请回答下列问题:
(1)括号内应提供的相应条件和物质 、 。
(2)方框中所得物质的化学式 。
(3)使用浓硫酸并加热到250℃~300℃的目的是 。
(4)②处加Na2CO3溶液所发生反应的离子方程式 、 。
(5)滤渣2的主要成分有 。
(6)如何检验Li2CO3是否洗涤干净? 。
(1)加热或高温(1分) C和高温 (2分) (2) SiO2 (1分)
(3)减少杂质的溶解、提高Li2SO4的浸出率、加快浸出速率(每项1分,共2分,任意两项均得2分,其它合理答案也可)
(4) Ca2+ + CO32- = CaCO3↓(1分) CaSO4 + CO32- = CaCO3 + SO42- (2分)
(5) Mg(OH)2和CaCO3 (每个1分,共2分)
(6)取最后一次洗涤液少许于试管中,先在其中加入足量稀盐酸,然后滴入几滴BaCl2溶液,若未出现白色沉淀,则洗涤干净,反之则不干净。(其它合理答案也可,2分)
(3)减少杂质的溶解、提高Li2SO4的浸出率、加快浸出速率(每项1分,共2分,任意两项均得2分,其它合理答案也可)
(4) Ca2+ + CO32- = CaCO3↓(1分) CaSO4 + CO32- = CaCO3 + SO42- (2分)
(5) Mg(OH)2和CaCO3 (每个1分,共2分)
(6)取最后一次洗涤液少许于试管中,先在其中加入足量稀盐酸,然后滴入几滴BaCl2溶液,若未出现白色沉淀,则洗涤干净,反之则不干净。(其它合理答案也可,2分)
试题分析:H4SiO4加热生成SiO2,SiO2与C在高温条件下反应生成单质Si和CO,所以(1)括号内相应条件和物质分别为加热、C和高温;(2)方框中物质为H4SiO4加热分解的产物:SiO2。
(3)使用浓硫酸并加热到250℃~300℃的目的是减少杂质的溶解、提高Li2SO4的浸出率、加快浸出速率。
(4)加入H2SO4后生成CaSO4,CaSO4微溶,含Ca2+和CaSO4固体,所以加入Na2CO3反应的离子方程式为:Ca2+ +CO32- =CaCO3↓、CaSO4+CO32- =CaCO3+SO42?。
(5)加入Ca(OH)2和Na2CO3后,OH?与溶液中的Mg2+反应,Ca2+与CO32?反应,所以滤渣2的主要成分为Mg(OH)2和CaCO3。
(6)假如Li2CO3没有洗涤干净,表面会沾附Na2SO4溶液,所以用稀盐酸和BaCl2溶液进行检验。

练习册系列答案
相关题目
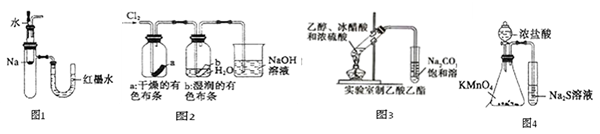
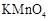 、
、 和S氧化性的相对强弱
和S氧化性的相对强弱