题目内容
13.已知NA为阿伏伽德罗常数的值.下列说法不正确的是( )| A. | 12g金刚石中平均含有2NA个σ键 | B. | 1molSiO2晶体中平均含有4NA个σ键 | ||
| C. | 12g石墨中平均含1.5NA个σ键 | D. | 1molCH4中含4NA个s-pσ键 |
分析 A.在金刚石中每个C原子可形成的C-Cσ键为4个;每条C-C键被两个C原子共用;
B.根据在二氧化硅晶体中,一个硅原子与4个氧原子形成4条Si-Oσ键来判断;
C.石墨中每个C原子与其它3个C原子形成3个C-Cσ键,则平均每个C原子成键数目为3×$\frac{1}{2}$=1.5个;
D.甲烷中4个C-H是sP3杂化.
解答 解:A.金刚石中每个C原子可形成的C-Cσ键为4个;每条C-C键被两个C原子共有,每个碳原子可形成:4×$\frac{1}{2}$=2个C-C键,则12g金刚石即1mol,含 C-Cσ键2mol,即个数为2NA,故A正确;
B.在二氧化硅晶体中,每个硅原子与4个氧原子形成4条Si-Oσ键,1molSiO2晶体中平均含有4NA个σ键,故B正确;
C.石墨中每个C原子与其它3个C原子形成3个C-Cσ键,则平均每个C原子成键数目为3×$\frac{1}{2}$=1.5个,12g石墨物质的量为$\frac{12g}{12g/mol}$=1mol,平均含1.5NA个σ键,故C正确;
D.甲烷中4个C-H是sP3杂化,不是s-p杂化,故D错误;
故选:D.
点评 本题考查物质结构中的化学键数目的计算,侧重于学生的分析能力和计算能力的考查,熟悉金刚石、二氧化硅、石墨、甲烷结构是解题关键,注意甲烷中C原子的sp3杂化轨道,题目难度中等.

练习册系列答案
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案
相关题目
4.下列现象因发生物理变化引起的是( )
| A. | 活性炭使蓝色墨水褪色 | |
| B. | 盛石灰水的试剂瓶久置后内壁出现白色固体 | |
| C. | 蛋白质灼烧时发出烧焦羽毛的气味 | |
| D. | 湿润红布条置于氯气的集气瓶中,红布条褪色 |
8.标准状况下,22.4LCO2的物质的量为( )
| A. | 0.20mol | B. | 0.50mol | C. | 1.0mol | D. | 2.0mol |
18.下列叙述不正确的是( )
| A. | 将w g a%的NaCl溶液蒸发掉$\frac{w}{2}$g水,得到2a%的NaCl溶液 | |
| B. | 将1体积c mol/L的硫酸用水稀释为5体积,稀溶液的物质的量浓度为0.2c mol/L | |
| C. | 将5.85 g NaCl晶体溶于水配成1L溶液,制得0.01 mol/L的NaCl溶液 | |
| D. | 1 mol•L-1 AlCl3溶液中Cl-的物质的量浓度与3 mol•L-1NH4Cl溶液中Cl-的物质的量浓度相等 |
5.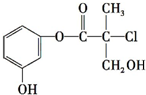 现有结构简式如图所示的某有机物,它是药物生产的中间体,关于该有机物叙述正确的是( )
现有结构简式如图所示的某有机物,它是药物生产的中间体,关于该有机物叙述正确的是( )
 现有结构简式如图所示的某有机物,它是药物生产的中间体,关于该有机物叙述正确的是( )
现有结构简式如图所示的某有机物,它是药物生产的中间体,关于该有机物叙述正确的是( )| A. | 该有机物与溴水发生加成反应 | |
| B. | 该有机物与浓硫酸混合加热可发生消去反应 | |
| C. | 该有机物经催化氧化后能发生银镜反应 | |
| D. | 1mol该有机物与足量NaOH溶液反应最多消耗3molNaOH |
2.下列说法正确的是( )
| A. | 盐类发生水解的过程中,溶液的pH一定发生改变 | |
| B. | 向K2CO3溶液中通入CO2可使溶液中的c(CO32-)变大 | |
| C. | 向Na2SO3溶液中通入Cl2,溶液的导电性变强 | |
| D. | 一定温度下的密闭容器中,反应2NO2?N2O4达平衡时,再加入1molN2O4,平衡正向移动,且N2O4含量增大 |
3.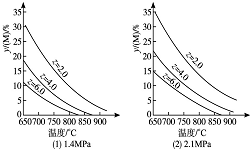 反应aM(g)+bN(g)?cP(g)+dQ(g)达到平衡时,M的体积分数y(M)与反应条件的关系如图所示.其中z表示反应开始时N的物质的量与M的物质的量之比.下列说法不正确的是( )
反应aM(g)+bN(g)?cP(g)+dQ(g)达到平衡时,M的体积分数y(M)与反应条件的关系如图所示.其中z表示反应开始时N的物质的量与M的物质的量之比.下列说法不正确的是( )
 反应aM(g)+bN(g)?cP(g)+dQ(g)达到平衡时,M的体积分数y(M)与反应条件的关系如图所示.其中z表示反应开始时N的物质的量与M的物质的量之比.下列说法不正确的是( )
反应aM(g)+bN(g)?cP(g)+dQ(g)达到平衡时,M的体积分数y(M)与反应条件的关系如图所示.其中z表示反应开始时N的物质的量与M的物质的量之比.下列说法不正确的是( )| A. | 同温同压同z时,加入催化剂,平衡时Q的体积分数不改变 | |
| B. | 同温同压时,增加z,平衡时Q的体积分数一定增加 | |
| C. | 同温同z时,增加压强,平衡时Q的体积分数一定减小 | |
| D. | 同压同z时,升高温度,平衡时Q的体积分数一定增加 |