题目内容
【题目】Ⅰ.分析下列仪器装置图,回答下列问题:
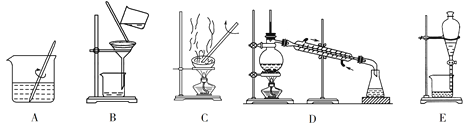
(1)粗盐的提纯需要上面的哪些装置?__________(填字母符号,下同)。
(2)分离以下混合物应该选择使用什么装置?
①酒精和水:_______;②食盐和水:_________;③花生油和水:_______。
Ⅱ.下图是为完成相应实验的装置图,请分析指出其中一处错误。
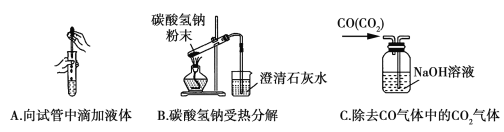
A:___________________________________;
B:___________________________________;
C:___________________________________。
【答案】ABCDCE滴管口伸入试管中试管口向上混合气体从短导管进入洗气瓶
【解析】
Ⅰ.上述装置中,A为溶解,B为过滤,C为蒸发,D为蒸馏,E为分液。
(1)粗盐提纯需要溶解(A)后,过滤(B)除去不溶性杂质,蒸发(C)得到食盐(不纯),故答案为:ABC;
(2)①酒精和水互溶,但沸点不同,利用蒸馏分离,故答案为:D;
②食盐溶于水,应选蒸发分离出NaCl,故答案为:C;
③花生油和水不混溶,混合物会分层,应选分液法分离,故答案为:E;
Ⅱ.A.为防止污染试剂,胶头滴管不能插入试管中,故答案为:滴管口伸入试管中;
B.加热固体,试管口应略向下倾斜,否则可能导致试管炸裂,故答案为:试管口向上;
C.导管应长进短出,否则不能起到洗气的作用,故答案为:混合气体从短导管进入洗气瓶。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目