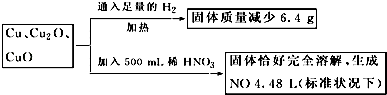题目内容
【题目】惰性电极电解NaCl溶液或CuSO4溶液都得到三种产物A、B、C,各物质之间的转化关系如下图所示(图中参与反应和生成的水都已略去)。已知甲是短周期元素的单质,它是日常生活中常用的包装材料。

回答下列问题:
(1)若电解的是NaCl溶液:
①甲与A反应的化学方程式是________________________________。
②E与少量CO2反应的离子方程式是________________________________。
③常温下,若电解100mL 0.1 mol/L NaCl溶液,阴、阳两极各产生112mL气体(标准状况),则所得溶液的pH为___(忽略反应前后溶液的体积变化及气体溶于水的影响)。
(2)若电解的是CuSO4溶液,加热时,A的浓溶液可与B发生反应:
①A的浓溶液与B反应过程中,A的浓度随时间变化的图像正确是_________。

②E的化学式是______________;电解时阳极的电极反应式是___________________。
③若CuSO4溶液足量,电解后要恢复原来的浓度可加入 ________。
【答案】 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ ClO-+CO2+H2O=HClO+HCO3- 13 A SO2 4OH- -4e-=O2+2H2O 或2H2O-4e-=O2+4H+ CuO或CuCO3
【解析】(1)电解NaCl溶液生成NaOH、H2和Cl2,A+B→E+NaCl,说明A、B为NaOH和Cl2,C为H2,E是NaClO;甲是短周期元素的单质,是日常生活中常用的包装材料,甲+A→D+H2,则A是NaOH,甲是Al,B是Cl2。
①甲与A反应生成偏铝酸钠和氢气。故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
②E与少量CO2反应,即NaClO与少量CO2反应,生成HClO与HCO3-;
故答案为:ClO-+CO2+H2O=HClO+HCO3-。
③常温下,若电解100mL 0.1mol/LNaCl溶液,阴、阳两极各产生112mL气体(标况),即阴阳极分别产生0.005mol H2和Cl2。由2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑,可得:
2NaOH+H2↑+Cl2↑,可得:
n(OH-)=2n(Cl2)=0.01mol,c(OH-)=0.1mol/L,pH=13。
故答案为:13;
(2)若电解的是CuSO4溶液,生成的产物为Cu、O2和H2SO4,加热时,A的浓溶液可与B发生反应说明A为H2SO4,B为Cu,C为O2。
①A的浓溶液与B反应过程中,即浓硫酸和Cu反应,随着反应的进行,硫酸浓度减小,②铜和稀硫酸不发生反应,A的浓度随时间变化的图象是开始浓度减小,最后浓度不变。
故答案为:A;
②E是铜和浓硫酸加热反应生成SO、水和硫酸铜,所以E为SO2,电解时阳极是OH-放电,故电极反应为:4OH--4e-=2H2O+O2↑或2H2O-4e-=O2↑+4H+。
故答案为:SO2;4OH--4e-=2H2O+O2↑或2H2O-4e-=O2↑+4H+。
③若CuSO4足量,则阴极产物只有Cu,阳极是O2,且二者物质的量之比为2∶1;若要将溶液恢复到原来的浓度,可加入CuO固体,或者CuCO3固体,CuCO3+2H+=Cu2++H2O+CO2↑)。
故答案为:CuO或CuCO3