题目内容
17.重水(D2O)是重要的核工业原料,下列说法错误的是( )| A. | H2O与D2O互称同素异形体 | |
| B. | 1H218O与D216O的相对分子质量相同 | |
| C. | 氘(D)原子核外有1个电子 | |
| D. | 1H与D互为同位素 |
分析 A.同种元素形成的不同单质互为同素异形体;
B.1H218O的相对分子质量为:1×2+18=20,D216O的相对分子质量为:2×2+16=20;
C.氘(D)质子数为1,质子数=核外电子数;
D.具有相同质子数、不同中子数的原子互为同位素.
解答 解:A.H2O与D2O均为水,属于化合物,不互为同素异形体,故A错误;
B.1H218O的相对分子质量为:1×2+18=20,D216O的相对分子质量为:2×2+16=20,两者相对分子质量相同,故B正确;
C.氘(D)质子数为1,质子数=核外电子数,故原子核外有1个电子,故C正确;
D.具有相同质子数,不同中子数的原子或同一元素的不同核素互为同位素,1H与D质子数都为1,中子数分别为0、1,互为同位素,故D正确;
故选A.
点评 本题考查同素异形体及同位素,把握相关的概念及核变化为解答的关键,选项B为解答的易错点,注重基础知识的考查,题目难度不大.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案
相关题目
2.在浓盐酸中H3AsO3与SnCl2反应的离子方程式为:3SnCl2+12Cl-+6H++2H3AsO3═2As+3SnCl62-+6M,关于该反应的说法中正确的组合是( )
①氧化剂是H3AsO3、②还原性:As>SnCl2、③每生成1mol As,反应中转移电子的物质的量为3mol、④M为OH-、⑤SnCl62-是氧化产物.
①氧化剂是H3AsO3、②还原性:As>SnCl2、③每生成1mol As,反应中转移电子的物质的量为3mol、④M为OH-、⑤SnCl62-是氧化产物.
| A. | ①③⑤ | B. | ①②④⑤ | C. | ①②③④ | D. | 只有①③ |
3.聚四氟乙烯可以作为不粘锅的内衬,其结果简式是( )
| A. |  | B. |  | C. |  | D. |  |
5.下列说法不正确的是( )
| A. | 法国科学家拉瓦锡用定量化学实验阐述了燃烧的氧化学说,推翻了燃素说 | |
| B. | 俄国科学家门捷列夫制作出世界上第一张元素周期表 | |
| C. | 意大利科学家阿伏伽德罗发现了阿伏伽德罗常数 | |
| D. | 英国科学家道尔顿提出了近代原子学说 |
2.如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )
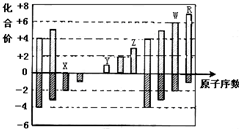

| A. | WX3和水反应形成的化合物是弱电解质 | |
| B. | 气态氢化物的还原性:R>W | |
| C. | 离子半径:Z>Y>X | |
| D. | Y、Z、R三种元素分别形成的最高价氧化物对应的水化物两两间能发生反应 |
9.下列除去杂质的方法中正确的是( )
①除去乙烷中少量的乙烯:通入适量H2,加催化剂反应
②除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤、分液、干燥、蒸馏
③除去硝基苯中少量的NO2:滴入适量的NaOH溶液后,过滤
④除去乙醇中少量的乙酸:加足量生石灰,蒸馏
⑤除去蛋白质中少量离子:用半透膜,渗析.
①除去乙烷中少量的乙烯:通入适量H2,加催化剂反应
②除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤、分液、干燥、蒸馏
③除去硝基苯中少量的NO2:滴入适量的NaOH溶液后,过滤
④除去乙醇中少量的乙酸:加足量生石灰,蒸馏
⑤除去蛋白质中少量离子:用半透膜,渗析.
| A. | ①②④ | B. | ②③④ | C. | ②④⑤ | D. | ③④⑤ |
6.如表对应关系不正确的是( )
| 序号 | 俗称 | 主要成分 | 主要作用或用途 |
| A | 漂白粉 | Ca(ClO)2和CaCl2 | 可做漂白剂或环境消毒剂 |
| B | 硅胶 | H2SiO3 | 可做实验室或袋装食品、瓶装药品的干燥剂 |
| C | 石英 | SiO2 | 可做饰品、光纤材料以及半导体材料等 |
| D | 纯碱 | Na2CO3 | 可用于造纸、制玻璃等 |
| A. | A | B. | B | C. | C | D. | D |
7.下列说法正确的是( )
| A. | 增大反应物浓度,可增大单位体积内活化分子百分数,使有效碰撞次数增大 | |
| B. | 有气体参加的化学反应,若缩小反应容器的体积,可增加活化分子的百分数,从而使反应速率增大 | |
| C. | 升高温度能使化学反应速率增大,主要原因是增加了活化分子的百分数 | |
| D. | 催化剂不影响反应活化能但能增大单位体积内活化分子百分数,从而增大反应速率 |

 ;
;