题目内容
有关下图的说法正确的是( )
| A.构成原电池时溶液中SO42-移向Cu极 |
| B.构成原电池时Cu极反应为: Cu﹣2e-=Cu2+ |
| C.要使Fe极不被腐蚀,Cu片换Zn片或a接直流电源负极 |
| D.a和b分别接直流电源正、负极,Fe片上有气体产生 |
C
解析试题分析:如图构成原电池则Fe作负极失去电子形成Fe2+ 吸引SO42- ,所以SO42- 向铁电极移动,A错误;构成原电池正极发生反应的反应式Cu2++2e-=Cu,B错误;要使铁电极不被腐蚀,则铁电极应该作原电池的正极或电解池的阴极从而受保护,因此把Cu片换Zn片,Zn比Fe活泼,Fe做正极被保护,若a接电源负极,则Fe电极为阴极也被保护,所以C正确;若a和b分别接直流电源正、负极,则Fe作阳极要溶解,不会有气体产生,D错误。
考点:本题考查的是电化学基础。

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案关于下列各装置图的叙述中,不正确的是 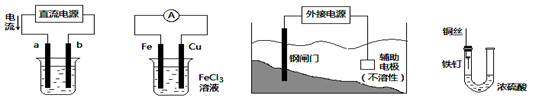
① ② ③ ④
| A.用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液 |
| B.装置②的总反应是:Cu+2Fe3+=Cu2++2Fe2+ |
| C.为防止钢闸门被腐蚀,装置③中钢闸门应与外接电源的负极相连 |
| D.装置④中的铁钉几乎没被腐蚀 |
气态废弃物中的硫化氢可用电化学的方法转化为可利用的硫:配制一份电解质溶液,主要成分为:K4[Fe(CN)6](200 g/L)和KHCO3(60 g/L);通电电解,通入H2S气体。过程中涉及硫化氢转化为硫的总反应:2Fe(CN)63-+2CO32-+H2S=2Fe(CN)64-+2HCO3-+S,则下列说法不正确的是( )
| A.电解过程中的阳极反应为:[Fe(CN)6]2――e-=[Fe(CN)6]3- |
| B.电解过程中阴极附近溶液的pH降低 |
| C.电解过程中每处理l mol硫化氢气体,理论上转移电子2 mol |
| D.该处理方法理论上不需要补充电解质溶液 |
如图所示是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录如下,则卡片上的描述合理的是( )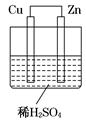
| 卡片号:2 2013.3.15,实验后的记录: ①Cu为负极,Zn为正极 ②Cu极上有气泡产生 ③SO42– 向Cu极移动 ④ 若有0.5mol电子流经导线,则可产生0.25mol气体 ⑤ 电子的流向是:Cu→Zn ⑥正极反应式:Cu +2e- = Cu2+ |
铅蓄电池是一种用途极广的二次电池,其电池反应为:
下列说法不正确的是
| A.放电时,负极质量增加 |
| B.充电时,应将外接直流电源的正极与蓄电池的铅电极相接 |
C.放电时,正极反应为: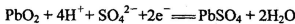 |
| D.铅蓄电池做电源电解Na2SO4溶液时,当有lmolO2产生时,消耗4molH2SO4 |
有一种纸质软电池,该电池采用薄层纸片作为载体和传导体,一面附着锌,另一面附着二氧化锰。电池总反应为Zn+2MnO2+H2O=ZnO+2MnO(OH),关于此电池,下列说法正确的是
| A.该电池Zn为负极,ZnO为正极,MnO2催化剂] |
| B.该电池的正极反应为MnO2+e-+H2O=MnO(OH)+OH- |
| C.放电时外电路电子由Zn流向MnO2,内电路电子由MnO2流向Zn |
| D.电池工作时OH-通过薄层纸片向附着二氧化锰的电极移动 |
用Na2SO3溶液吸收硫酸工业尾气中的二氧化硫,将所得的混合液进行电解循环再生,这种新工艺叫再生循环脱硫法。其中阴、阳离子交换膜组合循环再生机理如图所示, 则下列 有关说法中不正确的是( )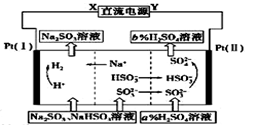
| A.X为直流电源的负极,Y为直流电源的正极 |
| B.阳极区pH增大 |
| C.图中的b>a |
| D.该过程中的产品主要为H2SO4和H2 |
用惰性电极实现电解,下列说法中正确的是 ( )
| A.电解稀硫酸溶液,实质上是电解水,故溶液pH不变 |
| B.电解稀氢氧化钠溶液,要消耗OH-,故溶液pH减小 |
| C.电解硫酸钠溶液,在阴极上和阳极上析出产物的物质的量之比为1∶2 |
| D.电解氯化铜溶液,阴极和阳极产物的物质的量之比为1∶1 |
 从右向左移动。下列分析正确的是
从右向左移动。下列分析正确的是
