题目内容
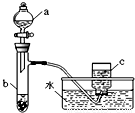
甲、乙两组同学分别对铜、铁与硝酸的反应进行探究,请你参与并完成对有关问题的解答.(1)甲组同学采用如右图所示装置验证铜与硝酸的反应.已知仪器a中盛有足量一定浓度的硝酸溶液,试管b中盛有3.2g铜.
①请写出铜与稀硝酸反应的离子反应方程式 .
②在铜与硝酸的反应中,硝酸所表现出的化学性质主要有 .
③仪器c中收集的气体主要是 .(填分子式)
④待试管b中反应进行完全,如果向b中液体里加入足量氢氧化钠溶液,可生成沉淀的质量是 g.
(2)乙组同学对铁与稀硝酸的反应进行探究.他们用a mol Fe和含有b mol HNO3的稀硝酸进行实验,若两种物质恰好反应都无剩余,且HNO3只被还原成NO,反应结束后溶液中含有Fe3+和Fe2+.则
①反应结束后的溶液中NO3-的物质的量的取值范围是 .(用含a的代数式等表示)
②若反应结束后的溶液中Fe3+、Fe2+的物质的量之比n(Fe3+):n(Fe2+) 为3:1,则b:a的值为 .
【答案】分析:(1)①铜与稀硝酸反应生成硝酸铜、一氧化氮、水,据此书写;
②反应中N元素的化合价部分未变化生成硝酸铜,部分降低生成氮的氧化物;
③进入仪器c的气体为NO2,NO2与水反应生成NO;
④铜完全反应生成硝酸铜,向b中液体里加入足量氢氧化钠溶液,铜离子完全转化为氢氧化铜沉淀,根据n=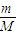 计算铜的物质的量,根据铜原子守恒计算氢氧化铜的物质的量,再根据m=nM计算;
计算铜的物质的量,根据铜原子守恒计算氢氧化铜的物质的量,再根据m=nM计算;
(2)①利用极限法分析解答,全部为Fe3+时,溶液中NO3-的物质的量最大,全部为Fe2+时,溶液中NO3-的物质的量最小,据此解答;
②用a表示出溶液中Fe3+、Fe2+的物质的量,进而用a表示出溶液中NO3-的物质的量,根据氮原子守恒用a、b表示出NO的物质的量,根据电子转移守恒解答.
解答:解:(1)①铜与稀硝酸反应生成硝酸铜、一氧化氮、水,反应离子方程式为:3Cu+8H++2NO3-═3Cu2++4H2O+2NO↑,
故答案为:3Cu+8H++2NO3-═3Cu2++4H2O+2NO↑;
②反应中N元素的化合价部分未变化生成硝酸铜,硝酸表现酸,性部分降低生成氮的氧化物,硝酸表现强氧化性,
故答案为:酸性和强氧化性;
③进入仪器c的气体为NO2,NO2与水反应生成NO,仪器c中收集的气体主要是NO,故答案为:NO;
④3.2g铜的物质的量为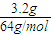 =0.05mol,向b中液体里加入足量氢氧化钠溶液,铜离子完全转化为氢氧化铜沉淀,根据铜原子守恒可知n[Cu(OH)2]=n(Cu)=0.05mol,故m[Cu(OH)2]=0.05mol×98g/mol=4.9g,故答案为:4.9;
=0.05mol,向b中液体里加入足量氢氧化钠溶液,铜离子完全转化为氢氧化铜沉淀,根据铜原子守恒可知n[Cu(OH)2]=n(Cu)=0.05mol,故m[Cu(OH)2]=0.05mol×98g/mol=4.9g,故答案为:4.9;
(2)①全部为Fe3+时,溶液中NO3-的物质的量最大,故NO3-的物质的量最大为3amol,全部为Fe2+时,溶液中NO3-的物质的量最小,故NO3-的物质的量最小为3amol,由于溶液中含有Fe3+和Fe2+,故2amol<n(NO3-)<3amol,
故答案为:2amol<n(NO3-)<3amol;
②n(Fe3+):n(Fe2+)=3:1,则n(Fe3+)= amol、n(Fe2+)=
amol、n(Fe2+)= amol,故溶液中n(NO3-)=3n(Fe3+)+2n(Fe2+)=
amol,故溶液中n(NO3-)=3n(Fe3+)+2n(Fe2+)= amol×3+
amol×3+ amol×2=
amol×2=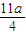 mol,由氮原子守恒可知,n(NO)=bmol-
mol,由氮原子守恒可知,n(NO)=bmol-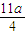 mol,根据电子转移守恒有:
mol,根据电子转移守恒有: amol×3+
amol×3+ amol×2=(b-
amol×2=(b-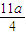 )mol×(5-2),整理得b:a=
)mol×(5-2),整理得b:a=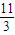 ,
,
故答案为: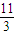 .
.
点评:本题考查硝酸的化学性质、化学计算等,难度中等,注意利用守恒思想与极限法的进行的计算.
②反应中N元素的化合价部分未变化生成硝酸铜,部分降低生成氮的氧化物;
③进入仪器c的气体为NO2,NO2与水反应生成NO;
④铜完全反应生成硝酸铜,向b中液体里加入足量氢氧化钠溶液,铜离子完全转化为氢氧化铜沉淀,根据n=
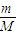 计算铜的物质的量,根据铜原子守恒计算氢氧化铜的物质的量,再根据m=nM计算;
计算铜的物质的量,根据铜原子守恒计算氢氧化铜的物质的量,再根据m=nM计算;(2)①利用极限法分析解答,全部为Fe3+时,溶液中NO3-的物质的量最大,全部为Fe2+时,溶液中NO3-的物质的量最小,据此解答;
②用a表示出溶液中Fe3+、Fe2+的物质的量,进而用a表示出溶液中NO3-的物质的量,根据氮原子守恒用a、b表示出NO的物质的量,根据电子转移守恒解答.
解答:解:(1)①铜与稀硝酸反应生成硝酸铜、一氧化氮、水,反应离子方程式为:3Cu+8H++2NO3-═3Cu2++4H2O+2NO↑,
故答案为:3Cu+8H++2NO3-═3Cu2++4H2O+2NO↑;
②反应中N元素的化合价部分未变化生成硝酸铜,硝酸表现酸,性部分降低生成氮的氧化物,硝酸表现强氧化性,
故答案为:酸性和强氧化性;
③进入仪器c的气体为NO2,NO2与水反应生成NO,仪器c中收集的气体主要是NO,故答案为:NO;
④3.2g铜的物质的量为
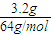 =0.05mol,向b中液体里加入足量氢氧化钠溶液,铜离子完全转化为氢氧化铜沉淀,根据铜原子守恒可知n[Cu(OH)2]=n(Cu)=0.05mol,故m[Cu(OH)2]=0.05mol×98g/mol=4.9g,故答案为:4.9;
=0.05mol,向b中液体里加入足量氢氧化钠溶液,铜离子完全转化为氢氧化铜沉淀,根据铜原子守恒可知n[Cu(OH)2]=n(Cu)=0.05mol,故m[Cu(OH)2]=0.05mol×98g/mol=4.9g,故答案为:4.9;(2)①全部为Fe3+时,溶液中NO3-的物质的量最大,故NO3-的物质的量最大为3amol,全部为Fe2+时,溶液中NO3-的物质的量最小,故NO3-的物质的量最小为3amol,由于溶液中含有Fe3+和Fe2+,故2amol<n(NO3-)<3amol,
故答案为:2amol<n(NO3-)<3amol;
②n(Fe3+):n(Fe2+)=3:1,则n(Fe3+)=
 amol、n(Fe2+)=
amol、n(Fe2+)= amol,故溶液中n(NO3-)=3n(Fe3+)+2n(Fe2+)=
amol,故溶液中n(NO3-)=3n(Fe3+)+2n(Fe2+)= amol×3+
amol×3+ amol×2=
amol×2=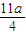 mol,由氮原子守恒可知,n(NO)=bmol-
mol,由氮原子守恒可知,n(NO)=bmol-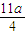 mol,根据电子转移守恒有:
mol,根据电子转移守恒有: amol×3+
amol×3+ amol×2=(b-
amol×2=(b-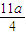 )mol×(5-2),整理得b:a=
)mol×(5-2),整理得b:a=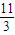 ,
,故答案为:
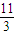 .
.点评:本题考查硝酸的化学性质、化学计算等,难度中等,注意利用守恒思想与极限法的进行的计算.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
 甲、乙两组同学分别对铜、铁与硝酸的反应进行探究,请你参与并完成对有关问题的解答.
甲、乙两组同学分别对铜、铁与硝酸的反应进行探究,请你参与并完成对有关问题的解答.

 2CaO+2S02↑+O2↑。
2CaO+2S02↑+O2↑。
 甲、乙两组同学分别对铜、铁与硝酸的反应进行探究,请你参与并完成对有关问题的解答.
甲、乙两组同学分别对铜、铁与硝酸的反应进行探究,请你参与并完成对有关问题的解答.