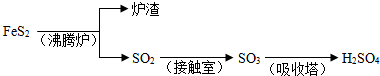
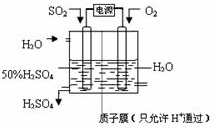
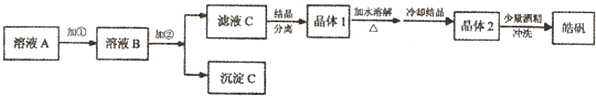
题目内容
下列反应中,为了制等量的氯气,起还原作用的HCl最少的是
A.MnO2+浓HCl B.KMnO4+HCl
C.KClO3+HCl D.电解盐酸(惰性电极)
C

练习册系列答案
相关题目
 中新社2008年10月30日报道,在从日本进口的日式酱油、芥末酱中检测出了甲苯和乙酸乙酯.试回答下列问题:
中新社2008年10月30日报道,在从日本进口的日式酱油、芥末酱中检测出了甲苯和乙酸乙酯.试回答下列问题:(1)下列有关甲苯的说法不正确的是
A.甲苯和苯互为同系物
B.甲苯主要是从石油中分离获得
C.甲苯在一定条件下能发生取代、加成及氧化反应
D.为了让油漆中的甲苯等有毒物质散逸,新装璜的住房应开窗充分通风
(2)工业上常以乙醇为唯一原料一步制取乙酸乙酯,该反应的化学方程式为
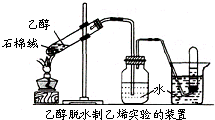
(3)某学习小组拟探究实验室制乙烯,试回答下列问题.
①实验室常用乙醇在浓硫酸作用下脱水制取乙烯,该反应的化学方程式为
②上述反应以浓硫酸为催化剂,可能出现的问题有
③下表是某次探究实验现象记载.据表可知,探究实验中反应最合适的催化剂及反应温度分别是
| 催化剂 | ①浓硫酸 | ②石棉绒 (闪石) |
③P2O5 | ④浓硫酸 石棉绒 |
⑤P2O5 石棉绒 |
| KMnO4/H+褪色情况 | 褪色 | 几乎不褪色 | 褪色 | 褪色 | 褪色 |
| 加热产生气体的时间 | 45s | 50s | 35s | 47s | 38s |
| 反应温度 | 170℃ | 180℃ | 82℃ | 170℃ | 87℃ |
| 气体气流量 | 多 | 很少 | 多 | 较多 | 较多 |
| 反应液炭化情况 | 严重 | 无炭化 | 无炭化 | 严重 | 无炭化 |
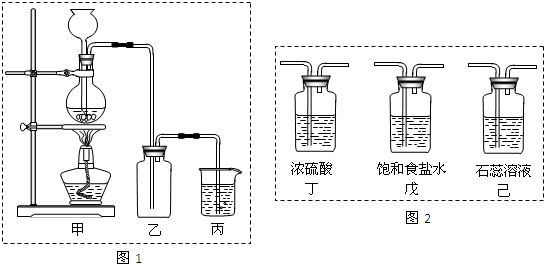
 完成以下实验:①用右图所示的装置制取溴乙烷;②进行溴乙烷的性质实验.在试管I中依次加入2mL 蒸馏水、4mL浓硫酸、2mL 95%的乙醇和3g溴化钠粉末,在试管Ⅱ中注入蒸馏水,在烧杯中注入自来水.加热试管I至微沸状态数分钟后,冷却.
完成以下实验:①用右图所示的装置制取溴乙烷;②进行溴乙烷的性质实验.在试管I中依次加入2mL 蒸馏水、4mL浓硫酸、2mL 95%的乙醇和3g溴化钠粉末,在试管Ⅱ中注入蒸馏水,在烧杯中注入自来水.加热试管I至微沸状态数分钟后,冷却.