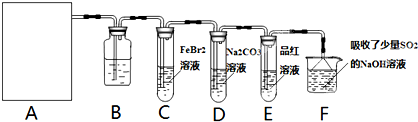
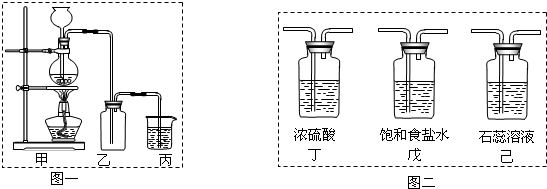
题目内容
氯气是一种重要的化工原料,自来水的消毒、农药的生产、药物的合成等都需要用到氯气.工业上通常采用电解法制氯气,其反应原理为:(用化学方程式表示)某化学兴趣小组欲采用图1装置制取氯气,并探究氯气的性质.

(1)指出图1装置中的错误之处
(2)丙装置的作用
(3)为了制得干燥纯净的Cl2,请你结合图2将以上装置重新排序:
(4)如果实验室中MnO2用完了,则下列物质可能可以用来代替MnO2制Cl2的是:
A.NaBiO3 B.FeCl3 C.PbO2 D.Na2O2
已知氧化性强弱顺序为:NaBiO3>PbO2>MnO2>Na2O2>FeCl3
(5)为证明氯气的强氧化性,有同学将图1中的“乙”换成“己”,你认为他这样做对吗?
分析:工业上制取氯气,是采用电解饱和食盐水的方法,在阴极上产生的氯离子放电得到氯气,阳极上氢离子放电得到氢气,电解方程式为:2NaCl+2H2O
2NaOH+H2↑+Cl2↑;实验仪器的使用规则,圆底烧瓶不能直接加热,需要垫上石棉网;长颈漏斗和分液漏斗的区别,分液漏斗的有一个旋塞,能控制液体的流量,便于控制反应速度,而长颈漏斗不具有此功能;实验室制取气体时有毒的气体不等直接排到空气中,会污染大气,因此需要有尾气处理装置;要得到纯净干燥的氯气,根据氯气中混有氯化氢气体,先将气体通入饱和食盐水,再通入浓硫酸将水除去;根据氧化性强弱顺序为:NaBiO3>PbO2>MnO2>Na2O2>FeCl3,二氧化锰能将HCl氧化,故NaBiO3、PbO2也能将HCl氧化,将氯水通入紫色石蕊试液中现象是先变红后退色,退色的原因是次氯酸的氧化作用.
| ||
解答:解:工业史上制取氯气是采用电解饱和食盐水的方法得到的在阴极上产生的氯离子放电得到氯气,阳极上氢离子放电得到氢气,
电解方程式为:2NaCl+2H2O
2NaOH+H2↑+Cl2↑,
故答案为:2NaCl+2H2O═2NaOH+H2↑+Cl2↑;
(1)化学实验的解题思路一般为,确定实验目的、组装实验装置、收集气体、尾气处理装置.本题实验装置中的烧瓶,是一种不能直接加热的仪器,对其进行加热需要垫上石棉网.长颈漏斗与分液漏斗相比较,分液漏斗上有一个旋塞,可以控制液体的流量,从而控制反应速率,同时长颈漏斗没有活塞,气体会从漏斗中出来.
故答案为:未用石棉网,用长颈漏斗而未用分液漏斗;
(2)氯气有毒多余的氯气如果直接排放的空气中,会污染大气,因此要将多余的氯气处理掉,根据氯气的性质可以用氢氧化钠将其吸收掉,反应方程式为:Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:吸收多余氯气,防止环境污染;Cl2+2OH-=Cl-+ClO-+H2O;
(3)为了制得干燥纯净的Cl2,实验室制取的氯气中会混有氯化氢气体、水蒸气,利用氯化氢极易溶于水,同时氯气在水中的溶解度较小,饱和食盐水能降低氯气的溶解度,故除去氯化氢气体中的氯气,可以将其通入饱和食盐水中,达到除去氯化氢的目的,同时又带出一部分水,再通过盛浓硫酸的洗气瓶将水除去.这样收集到纯净干燥的氯气.多余的氯气用氢氧化钠溶液吸收.
故答案为:甲 戊 丁 乙 丙;
(4)根据实验室制取氯气的反应原理MnO2+(浓)4HCl
Cl2↑+MnCl2+2H2O,二氧化锰的氧化性比氯气的氧化性强,发生氧化还原反应而得到氯气.同时根据题中的信息,氧化性强弱为:NaBiO3>PbO2>MnO2>Na2O2>FeCl3因此NaBiO3、PbO2也能将浓盐酸氧化得到氯气.
故答案为:AC;
(5)如果将“乙”换成“己”,己中盛有紫色的石蕊试液,将氯气通入后,对应的现象为溶液先变红后退色,变红是由于氯水中有HCl,有退色是由于新制的氯水中有HClO,HClO的氧化性将其氧化退色,故不能达到验证氯气氧化性的目的.
故答案为:不对;石蕊溶液褪色的是因为HClO的强氧化性而不是Cl2.
电解方程式为:2NaCl+2H2O
| ||
故答案为:2NaCl+2H2O═2NaOH+H2↑+Cl2↑;
(1)化学实验的解题思路一般为,确定实验目的、组装实验装置、收集气体、尾气处理装置.本题实验装置中的烧瓶,是一种不能直接加热的仪器,对其进行加热需要垫上石棉网.长颈漏斗与分液漏斗相比较,分液漏斗上有一个旋塞,可以控制液体的流量,从而控制反应速率,同时长颈漏斗没有活塞,气体会从漏斗中出来.
故答案为:未用石棉网,用长颈漏斗而未用分液漏斗;
(2)氯气有毒多余的氯气如果直接排放的空气中,会污染大气,因此要将多余的氯气处理掉,根据氯气的性质可以用氢氧化钠将其吸收掉,反应方程式为:Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:吸收多余氯气,防止环境污染;Cl2+2OH-=Cl-+ClO-+H2O;
(3)为了制得干燥纯净的Cl2,实验室制取的氯气中会混有氯化氢气体、水蒸气,利用氯化氢极易溶于水,同时氯气在水中的溶解度较小,饱和食盐水能降低氯气的溶解度,故除去氯化氢气体中的氯气,可以将其通入饱和食盐水中,达到除去氯化氢的目的,同时又带出一部分水,再通过盛浓硫酸的洗气瓶将水除去.这样收集到纯净干燥的氯气.多余的氯气用氢氧化钠溶液吸收.
故答案为:甲 戊 丁 乙 丙;
(4)根据实验室制取氯气的反应原理MnO2+(浓)4HCl
| ||
故答案为:AC;
(5)如果将“乙”换成“己”,己中盛有紫色的石蕊试液,将氯气通入后,对应的现象为溶液先变红后退色,变红是由于氯水中有HCl,有退色是由于新制的氯水中有HClO,HClO的氧化性将其氧化退色,故不能达到验证氯气氧化性的目的.
故答案为:不对;石蕊溶液褪色的是因为HClO的强氧化性而不是Cl2.
点评:本题是一道实验室制取气体的题目,要从以下几个反面考虑,实验原理、实验装置、干燥装置、性质验证装置、尾气处理装置,根据性质选择收集装置、尾气处理装置、除杂装置,易出错.

练习册系列答案
相关题目