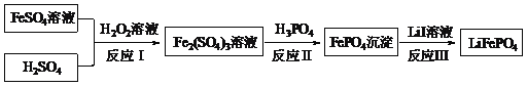题目内容
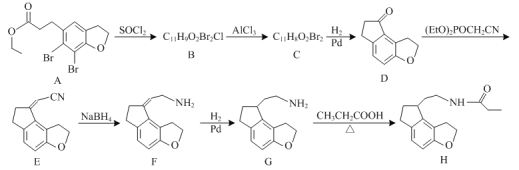
【题目】化合物H是一种治疗失眠症的药物,其一种合成路线如图:
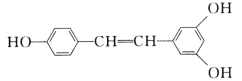
已知:![]()
(1)化合物G中所含官能团的名称为___和___。
(2)G→H的化学反应类型为___反应。
(3)化合物B的结构简式为___。
(4)E的一种同分异构体满足下列条件,写出该同分异构体的结构简式:___。
①含有萘环(![]() );
);
②能发生水解反应,水解所得两种产物中碳原子数之比为3∶10。
(5)写出以![]() 和(EtO)2POCH2CN为原料制备
和(EtO)2POCH2CN为原料制备![]() 的合成路线流程图(无机试剂和有机溶剂任用,合成路线例见本题题干)___。
的合成路线流程图(无机试剂和有机溶剂任用,合成路线例见本题题干)___。
【答案】氨基 醚键 取代 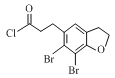
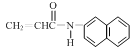 或
或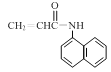
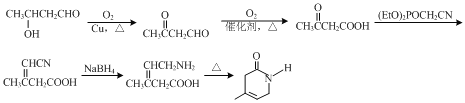 或
或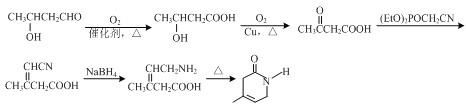
【解析】
根据B的分子式,A与SCl2发生取代反应,破坏酯基,生成B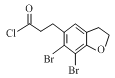 ,B分子在氯化铝作用下去一分子HCl成环,根据D的成环结构可以推断C的结构简式是
,B分子在氯化铝作用下去一分子HCl成环,根据D的成环结构可以推断C的结构简式是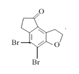 ,C在氢气和Pb的作用发生还原反应下转化为D,D应用已知信息转化为E,此反应为加长碳链的反应;E经过硼氢化钠的还原转化为F,F在催化剂Pb的作用下,分子内的碳碳双键与氢气发生还原反应转化为G,G和丙酸在加热条件下,脱水发生取代反应,生成H。
,C在氢气和Pb的作用发生还原反应下转化为D,D应用已知信息转化为E,此反应为加长碳链的反应;E经过硼氢化钠的还原转化为F,F在催化剂Pb的作用下,分子内的碳碳双键与氢气发生还原反应转化为G,G和丙酸在加热条件下,脱水发生取代反应,生成H。
(1)化合物G中所含官能团的名称为氨基和醚键;
(2)G中的氨基与丙酸中的羧基发生取代反应,形成肽键,故G→H的化学反应类型为取代反应;
(3)根据分析,化合物B的结构简式为 ;
;
(4)E的一种同分异构体满足下列条件含有萘环(![]() ),能发生水解反应(有肽键),且水解所得两种产物中碳原子数之比为3∶10,同时根据不饱和度分子有一个碳碳双键,故
),能发生水解反应(有肽键),且水解所得两种产物中碳原子数之比为3∶10,同时根据不饱和度分子有一个碳碳双键,故
 或
或 ;
;
(5)以![]() 为原料制备
为原料制备![]() ,需要加长碳链,应用已知信息
,需要加长碳链,应用已知信息![]() ,故合成图如下:
,故合成图如下: 或
或
 ,
,
或者![]() 用高锰酸钾得
用高锰酸钾得![]() (后续和以上相同)。
(后续和以上相同)。

【题目】酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是碳粉,MnO2,ZnCl2和NH4Cl等组成的糊状填充物,该电池在放电过程产生MnOOH,回收处理该废电池可得到多种化工原料,有关数据下表所示:
溶解度/(g/100g水)
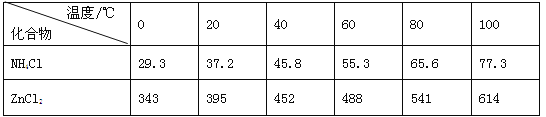
化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-17 | 10-17 | 10-39 |
回答下列问题:
(1)该电池的正极反应式为___,电池反应的离子方程式为___。
(2)维持电流强度为0.5A,电池工作五分钟,理论上消耗Zn___g。(已经F=96500C/mol)
(3)废电池糊状填充物加水处理后,过滤,滤液中主要有ZnCl2和NH4Cl,二者可通过___分离回收;滤渣的主要成分是MnO2、___和_______,欲从中得到较纯的MnO2,最简便的方法是___,其原理是___。
【题目】已知:① X、Y、Z、W、R、Q为原子序数依次增大的短周期元素。X 是所有元素中原子半径最小的元素,Y是形成化合物种类最多的元素,W的最外层电子数是次外层电子数的3倍,Q与W同主族,Y、R原子的最外层电子数之和等于Z的最外层电子数。
②莱纳斯·卡尔·鲍林在1932年提出electronegativity作为元素原子在化合物某种性质的标度,electronegativity的大小可以判断元素金属性与非金属性强弱,下表列出部分短周期元素的Electronegativity的值。
元素 | X | Y | Z | W | R | Q |
electronegativity | 2.1 | 2.5 | 3.0 | 3.5 | 0.9 | 2.5 |
元素 | Mg | Li | Al | Cl | P | Be |
electronegativity | 1.2 | 1.0 | 1.5 | 3.0 | 2.1 | 1.5 |
请回答下列问题(涉及X、Y、Z、W、R、Q时,用元素符号表示):
(1)根据上表给出的数据,可知元素的electronegativity越大,__(填“金属性”或“非金属性”)越强。
(2)元素Q在周期表中的位置为_________。
(3)W、R、Q单核简单离子半径由大到小排列顺序为______。
(4)元素X、Z、W之间能形成多种10电子微粒,请写出反应物和产物均为X、Z、W之间形成的10电子微粒的一个离子方程式______________。
(5)一种由元素W、R组成的白色固体化合物,其电子式为_______________。
(6)试比较稳定性:X2W_____ X2Q;沸点:X2W_____ X2Q (填“<”或“>”)。
(7)元素 X、Y、Z、W、R、Q中的两种元素可形成原子个数比为1∶2的共价化合物,则这两种元素的原子序数之差不可能是_________。
A.2 B.4 C.5 D.7