题目内容
汽车尾气主要含有CO2、CO、SO2、NO及汽油、柴油等物质,这种尾气越来越成为城市空气污染的主要来源,必须予以治理.治理的方法之一是在汽车的排气管上装一个“催化转换器”(用铂、钯合金作催化剂).它的特点是使CO与NO反应,生成可参与大气生态环境循环的无毒气体,并促使汽油、柴油等物质充分燃烧及SO2的转化.(1)汽车尾气中NO的来源是
A.汽油、柴油中含氮,是其燃烧产物
B.是空气中的N2与汽油、柴油的反应产物
C.是空气中的N2与O2在汽车气缸内的高温环境下的反应产物
D.是汽车高温尾气导致了空气中N2与O2的化合反应
(2)写出CO与NO反应的化学方程式:
(3)“催化转化器”的缺点是在一定程度上提高了空气的酸度,其原因是
(4)控制或者减少城市汽车尾气污染的方法可以有
A.开发氢能源B.使用电动车C.限制车辆行驶 D.使用乙醇汽油.
分析:(1)尾气中的氮氧化物是空气中的氮气和氧气在电火花条件下生成了一氧化氮,进而被氧气氧化为二氧化氮;
(2)根据题意知,一氧化碳和一氧化氮在催化剂条件下反应生成二氧化碳和氮气;
(3)二氧化硫被催化转化器转化为三氧化硫,三氧化硫极易溶于水生成硫酸;
(4)能减少或控制汽车尾气污染,则减少化石燃料的使用并开发新能源等.
(2)根据题意知,一氧化碳和一氧化氮在催化剂条件下反应生成二氧化碳和氮气;
(3)二氧化硫被催化转化器转化为三氧化硫,三氧化硫极易溶于水生成硫酸;
(4)能减少或控制汽车尾气污染,则减少化石燃料的使用并开发新能源等.
解答:解:(1)在电火花条件下,汽车缸内氮气和氧气反应生成一氧化氮气体,一氧化氮不稳定,易被氧气氧化生成二氧化氮,故答案为:C;
(2)一氧化碳和一氧化氮在催化剂条件下反应生成二氧化碳和氮气,反应方程式为2CO+2NO
2CO2+N2,故答案为:2CO+2NO
2CO2+N2;
(3)根据题意知,二氧化硫在催化转换器条件下和氧气发生氧化还原反应生成三氧化硫,三氧化硫极易和水蒸气反应生成硫酸,从而产生硫酸酸雾,提高了空气酸度,故答案为:SO2转化为SO3,产生了硫酸酸雾;
(4)A.开发氢能源,有利于减少污染,故正确;
B.使用电动车有利于减少污染,故正确;
C.限制车辆行驶不能控制污染,故错误;
D.使用乙醇汽油,乙醇汽油燃烧生成二氧化碳和水,有利于减少污染,故正确;
故答案为:ABD.
(2)一氧化碳和一氧化氮在催化剂条件下反应生成二氧化碳和氮气,反应方程式为2CO+2NO
| ||
| ||
(3)根据题意知,二氧化硫在催化转换器条件下和氧气发生氧化还原反应生成三氧化硫,三氧化硫极易和水蒸气反应生成硫酸,从而产生硫酸酸雾,提高了空气酸度,故答案为:SO2转化为SO3,产生了硫酸酸雾;
(4)A.开发氢能源,有利于减少污染,故正确;
B.使用电动车有利于减少污染,故正确;
C.限制车辆行驶不能控制污染,故错误;
D.使用乙醇汽油,乙醇汽油燃烧生成二氧化碳和水,有利于减少污染,故正确;
故答案为:ABD.
点评:本题考查氮的氧化物对环境的污染及环境保护,结合题给信息进行分析解答,知道合理利于资源,减少污染.

练习册系列答案
相关题目
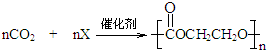 ,则X的结构简式为
,则X的结构简式为