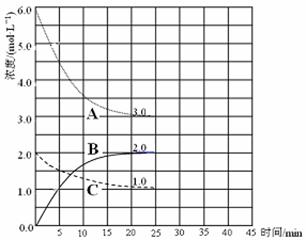
题目内容
物质的量的浓度相同的下列物质,在指定的离子浓度比较中错误的是( )
分析:A、电离后三者电离出的c(H+)逐渐增大,对产生PO43-的电离有抑制作用;
B、碳酸盐中碳酸根离子浓度大于碳酸氢根离子浓度,结合另一种离子对水解的影响分析判断;
C、依据硫酸铵和碳酸铵中的铵根离子浓度大于酸式盐中铵根离子浓度,依据连接的另一种离子对铵根离子水解影响程度分析判断;
D、硫化钠中 最大,硫化氢是二元弱酸,硫离子浓度最小,硫氢化钠和硫氢化铵比较,铵根离子水解促进硫氢根离子的水解;
B、碳酸盐中碳酸根离子浓度大于碳酸氢根离子浓度,结合另一种离子对水解的影响分析判断;
C、依据硫酸铵和碳酸铵中的铵根离子浓度大于酸式盐中铵根离子浓度,依据连接的另一种离子对铵根离子水解影响程度分析判断;
D、硫化钠中 最大,硫化氢是二元弱酸,硫离子浓度最小,硫氢化钠和硫氢化铵比较,铵根离子水解促进硫氢根离子的水解;
解答:A:考虑电离后三者电离出的c(H+)逐渐增大,对产生PO43-的电离有抑制作用,故A正确;
B:Na2CO3最大,其次是(NH4)2CO3,因为后者要发生水解,NaHCO3和NH4HCO3中由HCO3-电离产生,而NH4HCO3中HCO3-和NH4+相互促进水解,HCO3-浓度较小,NaHCO3>NH4HCO3,故B错误;
C:四种盐均完全电离,(NH4)2SO4 和(NH4)2CO3较大,但后者的阴阳离子会发生相互促进的水解,应为(NH4)2SO4>(NH4)2CO3,NH4HSO4 与NH4HCO3,NH4HSO4 电离产生的H+对NH4+的水解有抑制作用,应为NH4HSO4 >NH4HCO3,故C正确;
D:Na2S最大,NH4HS和NaHS相比,但前者发生双水解,应为NaHS>NH4HS,H2S 要电离产生S2-,为H2S的二级电离,程度很小,故D正确;
故选B,
B:Na2CO3最大,其次是(NH4)2CO3,因为后者要发生水解,NaHCO3和NH4HCO3中由HCO3-电离产生,而NH4HCO3中HCO3-和NH4+相互促进水解,HCO3-浓度较小,NaHCO3>NH4HCO3,故B错误;
C:四种盐均完全电离,(NH4)2SO4 和(NH4)2CO3较大,但后者的阴阳离子会发生相互促进的水解,应为(NH4)2SO4>(NH4)2CO3,NH4HSO4 与NH4HCO3,NH4HSO4 电离产生的H+对NH4+的水解有抑制作用,应为NH4HSO4 >NH4HCO3,故C正确;
D:Na2S最大,NH4HS和NaHS相比,但前者发生双水解,应为NaHS>NH4HS,H2S 要电离产生S2-,为H2S的二级电离,程度很小,故D正确;
故选B,
点评:本题考查了离子浓度大小比较的方法和特征,离子水解程度判断是解题关键,注意双水解的两种影响,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目

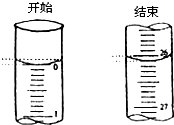 某学生欲用已知物质的量浓度的盐酸来滴定测定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:
某学生欲用已知物质的量浓度的盐酸来滴定测定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白: 2NH3(g)+
2NH3(g)+ O2(g) △H="+765.0kJ" /mol。
O2(g) △H="+765.0kJ" /mol。
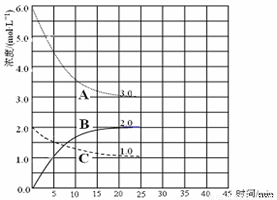
 2NH3(g)+
2NH3(g)+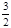 O2(g)
△H=+765.0kJ /mol。
O2(g)
△H=+765.0kJ /mol。