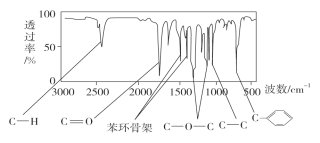
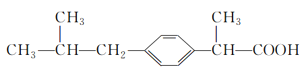
题目内容
【题目】在2L密闭容器中,起始投入4molN2和6molH2在一定条件下生成NH3,平衡时仅改变温度测得的数据如表所示(已知:T1<T2)
温度/K | 平衡时NH3的物质的量/mol |
T1 | 3.6 |
T2 | 2 |
(1)则K1__K2,(填“>”、“<”或“=”)原因:___。
(2)在T2下,经过10s达到化学平衡状态,则平衡时H2的转化率为__。若再同时增加各物质的量为1 mol,该反应的平衡v正__v逆,(>或=或<)平衡常数将___(填“增大”、“减小”或“不变”)
(3)下列能说明该反应已达到平衡状态的是__。
A.3v正(H2)=2v逆(NH3) B.容器内气体压强不变
C.混合气体的平均相对分子质量不再改变的状态 D.c(H2)=c(NH3)
【答案】> 温度升高,平衡逆向移动,K减小 50﹪ > 不变 BC
【解析】
(1)合成氨为放热反应,升高温度,平衡逆向移动,平衡常数减小;
(2)根据方程式利用三段法进行计算;
(3)达到平衡状态时,正反应速率等于逆反应速率,各物质的质量或浓度保持不变,据此进行分析判断。
(1)合成氨为放热反应, T1<T2,升高温度,平衡逆向移动,平衡常数减小,所以K1>K2;
(2)设达到平衡时N2转化了x mol/L,根据三段法有
N2 + 3H2 ![]() 2NH3
2NH3
始(mol/L) 2 3 0
转(mol/L) 0.5 1.5 1
平(mol/L) 1.5 1.5 1
平衡时H2的转化率=![]() ×100%=50%;平衡常数K=
×100%=50%;平衡常数K=![]() =0.2,
=0.2,
若再同时增加各物质的量为1 mol,根据三段法有:
N2 + 3H2 ![]() 2NH3
2NH3
始(mol/L) 2 2 1.5
浓度商Qc=![]() =0.14<K,平衡正向移动,则v正>v逆,
=0.14<K,平衡正向移动,则v正>v逆,
平衡常数只与温度有关,温度不变,K不变;
(3)A. 当2v正(H2)=3v逆(NH3)时才能证明达到平衡状态,A项错误;
B.该反应为非等体积反应,容器内气体压强不变,证明反应达到平衡状态,B项正确;
C. 该反应为非等体积反应,混合气体的平均相对分子质量不再改变,证明反应达到了平衡状态,C项正确;
D.浓度相等并不能证明反应达到平衡状态,D项错误;
答案选BC。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】与化学平衡类似,电离平衡的平衡常数,叫做电离常数(用k表示).下表是25℃下几种常见弱酸的电离平衡常数:
酸 | 电离方程式 | 电离平衡常数K |
CH3COOH | CH3COOH | 1.96×10-5 |
HClO | HClO | 3.0×10-8 |
H2CO3 | H2CO3 HCO3- | K1=4.4×10-7 K2=5.6×10-11 |
H2SO3 | H2SO3 HSO3- | K1=1.54×10-2 K2= 1.02×10-7 |
回答下列问题:
(1)CH3COOH、HClO、H2CO3、HCO3-、H2SO3、HSO3-都可看作是酸,其中酸性最强的是_________,最弱的是________________。
(2)向Na2CO3溶液中通入足量的氯气,发生的离子方程式为______________________,向NaClO溶液中通入少量的二氧化硫,发生的离子方程式为____________________________________。
(3)求25℃时,1.2mol/L 的NaClO溶液pH=____________(己知:lg2=0.3),0.10mol/L的CH3COOH溶液中的c(H+)=______________mol/L。
【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是

选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |