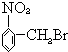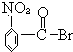题目内容
【题目】为了测定乙醇的结构式,有人设计了用无水酒精与钠反应的实验装置和测定氢气体积的装置进行实验.可供选用的实验仪器如图所示: 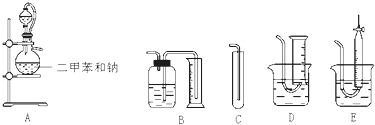
请回答以下问题:
(1)测量氢气体积的正确装置是(填写编号).
(2)装置中A部分的分液漏斗与蒸馏烧瓶之间连接的导管所起的作用是(填写编号).
A.防止无水酒精挥发
B.保证实验装置不漏气
C.使无水酒精容易滴下
(3)实验前预先将一小块钠在二甲苯中熔化成若干个小钠珠,冷却后倒入烧瓶中,其目的是 .
(4)已知无水酒精的密度为0.789gcm﹣3 , 移取2.0mL酒精,反应完全后(钠过量),收集到390mL(视作标准状况)气体.则一个乙醇分子中能被钠取代出的氢原子数为 , 由此可确定乙醇的结构简式为而不是 .
(5)实验所测定的结果偏高,可能引起的原因是(填写编号).
A.本实验在室温下进行
B.无水酒精中混有微量甲醇
C.无水酒精与钠的反应不够完全.
【答案】
(1)B
(2)C
(3)增大无水乙醇与钠的接触面积,使之充分反应
(4)1;CH3CH2OH;CH3﹣O﹣CH3
(5)AB
【解析】解:(1)由于反应放出的气体体积数较大(390mL),而装置C在收集方法与无法确定体积上都是不可取的;装置D、E是明显的干扰项,滴定管测量体积精确,容易误选,实际上本实验因放出气体体积达390mL,又只需三位有效数字(密度数值限制),而滴定管没有400mL的容量,中途续换将导致误差,所以使用装置B, 所以答案是:B;(2)导管使分液漏斗液面上方压力与蒸馏烧瓶内压力一致,可以使无水乙醇顺利流下,所以C正确,所以答案是:C;(3)二甲苯不参与反应,但与乙醇互溶可以增大无水乙醇与钠的接触面积,使之充分反应,所以答案是:增大无水乙醇与钠的接触面积,使之充分反应;(4)乙醇的质量为:m(C2H6O)=2.0mL×0.789gcm﹣3=1.578g,则乙醇的物质的量为:n(C2H6O)=1.578g/46gmol﹣1=0.0343mol,
由于0.0343molC2H6O与过量的Na完全反应可以生成0.390L H2 , 则1.00 mol C2H6O与Na反应能生成11.37 L H2 , 约为0.5 mol H2 , 也就是约为1mol H,即1个C2H6O分子中,只有1个H可以被Na置换,这说明C2H6O分子里的6个H中,有1个与其他5个是不同的,乙醇的结构简式为CH3CH2OH,而不是CH3﹣O﹣CH3 ,
所以答案是:1;CH3CH2OH;CH3﹣O﹣CH3;(5)A.本实验在室温下进行,测定的氢气的体积偏大,氢气的物质的量偏大,乙醇分子中能够被钠置换的氢原子数偏高,故A正确;
B.无水酒精中混有微量甲醇,导致羟基的物质的量增大,产生的氢气的物质的量偏大,测定结果偏高,故B正确;
C.无水酒精与钠的反应不够完全,会导致生成的氢气的物质的量偏小,测定结果偏低,故C错误;
所以答案是:AB.

 阅读快车系列答案
阅读快车系列答案【题目】根据Cl2 通入不同溶液(或水)中的实验现象,所得结论不正确的是
选项 | 溶液(或水) | 现象 | 结论 |
A | 蒸馏水 | 溶液呈浅黄绿色 | 氯水中存在Cl2分子 |
B | 品红溶液 | 溶液褪色 | Cl2有漂白性 |
C | AgNO3溶液 | 产生白色沉淀 | 氯水中存在Cl- |
D | Na2S溶液 | 产生淡黄色沉淀 | Cl2有氧化性 |
A. A B. B C. C D. D