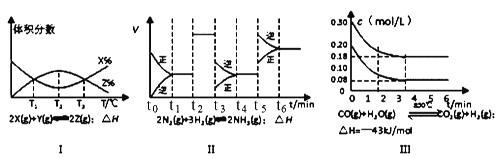题目内容
【题目】用脱脂棉包住约0.2 g过氧化钠固体粉末,置于石棉网上,然后向包有过氧化钠的位置滴加少量水,结果脱脂棉剧烈燃烧。
(1)由脱脂棉剧烈燃烧可得出过氧化钠与水反应的结论是:
a._______________________________________
b.______________________________________
(2)写出过氧化钠与水反应的离子方程式:________________________________________
(3)某研究性学习小组,拟用如图所示的装置进行实验,以证明上述2个结论。实验的操作方法及现象是:____________________

【答案】 有氧气生成 有大量的热放出 2Na2O2+2H2O=4Na++4OH-+O2↑ ①打开分液漏斗上口塞,打开旋塞K,使水由漏斗流下;②将带火星木条放在导管口A处,木条复燃;③导管口B处有气泡冒出。
【解析】(1)脱脂棉剧烈燃烧,说明该反应是放热反应,且反应中有助燃性气体生成,则实验结论为过氧化钠与水反应放出热量并氧气生成,故答案为:有氧气生成;有大量的热放出;
(2)过氧化钠与水反应生成氢氧化钠和氧气,反应的化学方程式2Na2O2+2H2O=4NaOH+O2↑,故答案为:2Na2O2+2H2O=4NaOH+O2↑;
(3)氧气具有使带火星的木条复燃的性质,所以可用带火星的木条靠近p处,如果木条复燃,则有氧气生成,反之无氧气生成;气体具有热胀冷缩的性质,如果该反应放热,放出的热量能使集气瓶内空气的压强增大;如果q导管插入盛水的小烧杯中,有气泡冒出,证明此反应放热,故答案为:打开分液漏斗上口塞,打开旋塞K,使水由漏斗流下,将带火星木条放在导管口A处,木条复燃,导管口B处有气泡冒出。

 一本好题口算题卡系列答案
一本好题口算题卡系列答案