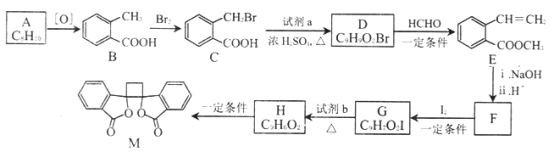
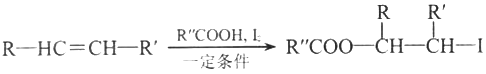
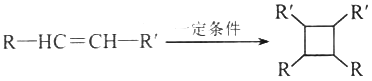题目内容
【题目】铝氢化钠(NaAlH4)是有机合成的重要还原剂,其合成线路如下图所示。

(1)制备无水AlCl:
实验装置如下。已知AlCl3178℃升华,在潮湿的空气中易水解。

①实验时应先点燃_______(填“A”或“D”)处酒精灯,当观察到_______时,再点燃另一处酒精灯。
②装置F的作用是_________________。
(2)制取铝氢化钠
制取铝氢化钠的化学方程式是_________________,AlCl3配成有机溶液的目的是__________。
(3)铝氢化钠样品性质探究和纯度测定
①称取一定质量实验制得的铝氢化钠样品(除含产物杂质外,还可能含有过量的NaH),滴加足量的水,观察到产生气体,该气体是________________。
②向反应后的溶液中滴加酚酞,溶液变红。猜想可能是生成了NaOH呈碱性,也可能
是_________________。为验证猜想,可再逐滴滴加盐酸并振荡,当观察到____________时,即可证明两种猜想均成立。
③设计如下两种装置测定生成气体的体积(若其他操作一致),用甲装置测得铝氢化钠的含量________乙装置。(填“大于”、“小于”或“等于”)。

【答案】 A D中充满黄绿色气体 吸收未反应的氯气,防止空气中的水蒸气进入装置或防止AlCl3水解 AlCl3+4NaH=NaAlH4+3NaCl 增大接触面加快反应,使A1Cl3反应更充分 H2 生成NaAlO2水解呈碱性 开始没有沉淀,后产生白色沉淀,溶液红色逐渐变浅(或消失) 小于
【解析】(1)要制备铝氯化铝,所以装置内就不要存有空气,先点燃A处酒精灯,产生氯气,利用氯气排装置内的空气,当D中充满黄绿色气体时,再点燃另一处酒精灯;正确答案:A ;D中充满黄绿色气体。
②氯气有毒,污染空气,AlCl3178℃升华,在潮湿的空气中易水解,因此装置F中装有碱石灰,吸收未反应的氯气,防止空气中的水蒸气进入装置或防止AlCl3水解 ;正确答案:吸收未反应的氯气,防止空气中的水蒸气进入装置或防止AlCl3水解。
(2)AlCl3+4NaH=NaAlH4+3NaCl;AlCl3配成有机溶液,即防止了水解,又能够增大接触面加快反应,使A1Cl3反应更充分;正确答案:AlCl3+4NaH=NaAlH4+3NaCl;增大接触面加快反应,使A1Cl3反应更充分。
(3)①NaH与水反应生成氢氧化钠和氢气,正确答案:氢气。
②生成了NaOH呈碱性,生成了偏铝酸钠溶液水解显碱性,可以向反应后的溶液中可再逐滴滴加盐酸并振荡,盐酸先与氢氧化钠溶液发生中和,开始没有沉淀,然后盐酸与偏铝酸钠溶液反应产生白色沉淀氢氧化铝,红色溶液颜色逐渐变浅;正确答案:H2 ;生成NaAlO2水解呈碱性开始没有沉淀,后产生白色沉淀,溶液红色逐渐变浅(或消失) 。
③利用甲装置进行反应时,产生的氢气和装置内的气体都进入到注射器内,测量出氢气的体积偏大,即氢化钠偏大,测得铝氢化钠的含量偏低,乙装置中外接一个导管,平衡大气压,避免了装置内的气体对氢气体积测定的影响;正确答案:小于。

 名题金卷系列答案
名题金卷系列答案【题目】下列四个试管中,过氧化氢分解产生氧气的反应速率最快的是 ( )
试管 | 温度 | 过氧化氢溶液浓度 | 催化剂 |
A | 常温 | 3% | — |
B | 常温 | 6% | — |
C | 水浴加热 | 3% | — |
D | 水浴加热 | 6% | MnO2 |
A. A B. B C. C D. D