题目内容
下表是元素周期表的一部分.
(1)元素①~⑩中原子半径最大是______(填元素符号),它的原子结构示意图为______.
(2)元素④氢化物的分子结构呈______型,它是由______键形成的______分子(后两空填“极性”或“非极性”).
(3)⑨的单质是良好的半导体材料,工业上常用④的单质与⑨的氧化物来制备粗制的⑨的单质,请写出该反应的化学方程式______.
(4)请写出元素⑦、⑧的最高价氧化物的水化物之间反应的离子方程式:______.
| 周期族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 1 | ① | ||||||
| 2 | ② | ③ | ④ | ⑤ | ⑥ | ||
| 3 | ⑦ | ⑧ | ⑨ | ⑩ |
(2)元素④氢化物的分子结构呈______型,它是由______键形成的______分子(后两空填“极性”或“非极性”).
(3)⑨的单质是良好的半导体材料,工业上常用④的单质与⑨的氧化物来制备粗制的⑨的单质,请写出该反应的化学方程式______.
(4)请写出元素⑦、⑧的最高价氧化物的水化物之间反应的离子方程式:______.
由元素在周期表的位置可知,①为H,②为Li,③为Be,④为C,⑤为N,⑥为O,⑦为Na,⑧为Al,⑨为Si,⑩为S,
(1)电子层越多,原子半径越大,同周期原子序数小的原子半径最大,则Na的原子半径最大,其质子数为11,原子结构示意图为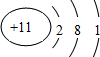 ,
,
故答案为:Na;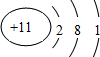 ;
;
(2)元素④氢化物为CH4,为正四面体构型,只含C-H极性共价键,但结构对称,为非极性分子,故答案为:正四面体;极性;非极性;
(3)C和SiO2高温下反应生成Si和CO,该反应为2C+SiO2
Si+2CO↑,故答案为:2C+SiO2
Si+2CO↑;
(4)⑦、⑧的最高价氧化物的水化物分别为NaOH、Al(OH)3,二者反应生成盐和水,该反应的离子反应为OH-+Al(OH)3=AlO2-+2H2O,
故答案为:OH-+Al(OH)3=AlO2-+2H2O.
(1)电子层越多,原子半径越大,同周期原子序数小的原子半径最大,则Na的原子半径最大,其质子数为11,原子结构示意图为
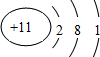 ,
,故答案为:Na;
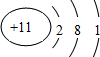 ;
;(2)元素④氢化物为CH4,为正四面体构型,只含C-H极性共价键,但结构对称,为非极性分子,故答案为:正四面体;极性;非极性;
(3)C和SiO2高温下反应生成Si和CO,该反应为2C+SiO2
| ||
| ||
(4)⑦、⑧的最高价氧化物的水化物分别为NaOH、Al(OH)3,二者反应生成盐和水,该反应的离子反应为OH-+Al(OH)3=AlO2-+2H2O,
故答案为:OH-+Al(OH)3=AlO2-+2H2O.

练习册系列答案
 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案
相关题目
