题目内容
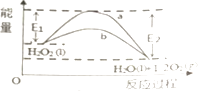
【题目】对于密闭容器中进行的可逆反应:2SO2(g)+O2(g) ![]() 2SO3(g),下列能判断该反应已经达到化学平衡状态的是( )
2SO3(g),下列能判断该反应已经达到化学平衡状态的是( )
A.SO2、O2、SO3的浓度相等
B.SO2、O2、SO3的浓度不再发生变化
C.SO2、O2、SO3在密闭容器中共存
D.反应停止,正、逆反应速率都等于零
【答案】B
【解析】解:A、SO2、O2、SO3的浓度相等,并不是不变,故A错误;
B、SO2、O2、SO3的浓度不再发生变化,则正逆反应速率相等,说明达平衡状态,故B正确;
C、任意时刻都是SO2、O2、SO3共存,故C错误;
D、化学平衡是动态平衡,当反应达到平衡状态时,正逆反应速率相等,但不为0,故D错误;
故选B.
【考点精析】本题主要考查了化学平衡状态的判断的相关知识点,需要掌握状态判断:①v(B耗)=v(B生)②v(C耗):v(D生)=x : y③c(C)、C%、n(C)%等不变④若A、B、C、D为气体,且m+n≠x+y,压强恒定⑤体系颜色不变⑥单位时间内某物质内化学键的断裂量等于形成量⑦体系平均式量恒定(m+n ≠ x+y)等才能正确解答此题.

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案【题目】短周期p区元素共有13种,除铝外全部是非金属元素。
(1)基态氮原子的价层电子排布图为_______________;短周期p区元素中,第一电离能最小的元素与电负性最大的元素组成的化合物是_______________(填化学式)。
(2)卤素与硼、氮、磷可形成BF3,NCl3和PBr3。下列有关以上三种分子的叙述正确的是_________;
A.化学键类型相同 B.空间构型相同
C.中心原子的杂化轨道类型相同 D.中心原子的价层电子对数相同
(3)CS2是一种溶剂,它能溶解硫磺。写出一种与CS2具有相同空间构型和键合形式的分子或离子______________。CO能与Ni形成正四面体型的配合物Ni(CO)4,3.42gNi(CO)4中含有_____molσ键。
(4)CCl4与水互不相溶,SiCl4与CCl4分子结构相似,但遇水极易发生水解反应,导致二者性质不同的原因是________________。
(5)铝的几种卤化物的熔点如下:
卤化铝 | AlF3 | AlCl3 | AlBr3 | AlI3 |
熔点/℃ | 1040 | 190 | 97.5 | 191 |
AlBr3的晶体类型是______,AlI3晶体中存在的作用力有_______________。
(6)氮化铝晶体为原子品体,是一种新型无机非金属材料,其晶体密度为ɑg/cm3,晶胞如图所示。
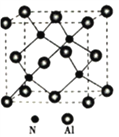
①铝原子的配位数为_______________。
②设NA为阿伏加德罗常数的值。氮化铝晶胞中,铝原子和氮原子之间最短的核间距为________nm。