题目内容
有原子序数依次递增的A、B、C三种元素,它们的原子次外层均为8个电子,其中C元素原子最外层电子数等于核外电子层数。A、B、C三种元素的元素符号依次为________________。取A、B、C三种元素的单质各m g,在室温下分别与V L 4 mol·L-1的盐酸充分反应。试推断下列三种情况下V值的取值范围(用含m的表达式表示)(1)当A、B、C三种单质放出的H2一样多时,____________________________________。
(2)当C单质与盐酸反应放出的H2最多时,_______________________________________。
(3)当A单质与盐酸反应放出的H2最多时,_______________________________________。
(4)当B、C两种单质分别与盐酸反应产生的H2几乎一样多时,______________________。
Na Mg Al (1)V=m/92 (2)V>m/48 (3)V<m/92 (4)V≤m/48
解析:不难推出C为铝,A为钠,B为镁。
用数轴法解题时,要找出刚好完全反应的特殊点,即金属与盐酸刚好完全反应时所用盐酸的体积。
m g钠与盐酸刚好完全反应时,所用盐酸的体积为V=m/92;m g镁与盐酸刚好完全反应时,所用盐酸的体积为V=m/48;m g铝与盐酸刚好完全反应时,所用盐酸的体积为V=m/36。
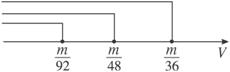
分析此数轴我们可以发现:在V≤m/92时,三种金属与盐酸反应放出的氢气一样多;在V≤m/48时,B、C与盐酸反应放出的氢气一样多;但只要V>m/48,则C(铝)与盐酸反应放出的氢气最多。

练习册系列答案
相关题目
X、Y、Z、M、W为五种短周期元素.X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76g?L-1;W的质子数是X、Y、Z、M四种元素质子数之和的
.下列说法正确的是( )
| 1 |
| 2 |
| A、原子半径:W>Z>Y>X>M |
| B、XZ2、X2M2、W2Z2均为直线型的共价化合物 |
| C、在上述五种元素形成的单质中由X元素形成的单质熔沸点最高 |
| D、由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键 |

