��Ŀ����
����Ŀ����ͼΪԪ�����ڱ���һ���֣���ش��������⣺ 
��1�����ٺ͢ݿ����γ�ԭ�Ӹ�����1��1�Ļ������ʱ�����ۣ��ٺ͢��γɵĻ�����ĵ���ʽΪ ��
��2���ں͢۵���ۺ����������ǿ��˳�����������ʽ����
��3���ܺ͢��γɵij���������ľ�������Ϊ �� ����ͨ���γ��˸þ��壮�ܺ͢��γɵij���������ľ�������Ϊ �� ����ͨ���γ��˸þ��壮
��4����Ϊ���ϵ���������װ��Ũ�����Ũ����������� ��
���𰸡�
��1����1��![]()
��2��HNO3��H2CO3
��3��ԭ�Ӿ��壻���ۼ������Ӿ��壻���Ӽ�������
��4��������Al��Ũ�����Ũ���ᷢ���ۻ�
���������⣺��Ԫ�������ڱ���λ�ÿ�֪����ΪH����ΪC����ΪN����ΪO����ΪNa����ΪAl����ΪSi����ΪCl����1�����ٺ͢ݿ����γ�ԭ�Ӹ�����1��1�Ļ�����ΪNaH��NaΪ+1�ۣ����ʱ���ԩ�1�ۣ��ٺ͢��γɵĻ�����ΪHCl�������ʽΪ 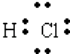 �����Դ��ǣ���1��
�����Դ��ǣ���1�� 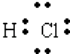 ����2��ͬ����������ҷǽ�������ǿ���ǽ�����Խǿ����ۺ����������Խǿ����ں͢۵���ۺ����������ǿ��˳��ΪHNO3��H2CO3 �� ���Դ��ǣ�HNO3��H2CO3����3���ܺ͢��γɵij���������ΪSiO2 �� ��������Ϊԭ�Ӿ��壬����ͨ�����ۼ��γ��˸þ��壻�ܺ͢��γɵij���������ΪCO2 �� ��������Ϊ���Ӿ��壬����ͨ�� ���Ӽ��������γ��˸þ��壬���Դ��ǣ�ԭ�Ӿ��壻���ۼ������Ӿ��壻���Ӽ�����������4����Ϊ���ϵ���������װ��Ũ�����Ũ����������dz�����Al��Ũ�����Ũ���ᷢ���ۻ����������ܵ�����Ĥ��ֹ��Ӧ�Ľ�һ�����������Դ��ǣ�������Al��Ũ�����Ũ���ᷢ���ۻ���
����2��ͬ����������ҷǽ�������ǿ���ǽ�����Խǿ����ۺ����������Խǿ����ں͢۵���ۺ����������ǿ��˳��ΪHNO3��H2CO3 �� ���Դ��ǣ�HNO3��H2CO3����3���ܺ͢��γɵij���������ΪSiO2 �� ��������Ϊԭ�Ӿ��壬����ͨ�����ۼ��γ��˸þ��壻�ܺ͢��γɵij���������ΪCO2 �� ��������Ϊ���Ӿ��壬����ͨ�� ���Ӽ��������γ��˸þ��壬���Դ��ǣ�ԭ�Ӿ��壻���ۼ������Ӿ��壻���Ӽ�����������4����Ϊ���ϵ���������װ��Ũ�����Ũ����������dz�����Al��Ũ�����Ũ���ᷢ���ۻ����������ܵ�����Ĥ��ֹ��Ӧ�Ľ�һ�����������Դ��ǣ�������Al��Ũ�����Ũ���ᷢ���ۻ���

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ������ѡ���е��������������ȷ����
ѡ�� | ���� | ��� |
A | ������ʯ�͡��ɱ� | ����� |
B | ˮ�������ʯ��ˮ�� | ���� |
C | ���������ᡢˮ | ����� |
D | ���ᡢ�Ҵ���ʯīϩ | ���ۻ����� |
A. AB. BC. CD. D

